
3.根据平衡常数进行的有关计算
2. 平衡常数K的性质和意义
①.平衡常数K与温度有关,与浓度和压强无关。
②.平衡常数K的大小,可推断反应进行的程度。K越大,表示反应进行的程度越大,反应物的转化率越大;K越小,表示反应进行的程度越小,反应物的转化率越小。一般来说,反应的平衡常数K≥105认为正反应进行得较完全;K≤10-5认为这个反应的正反应很难进行(逆反应较完全)
③.平衡常数表达式表明在一定温度条件下达成平衡的条件。在某温度下,某时刻反应是否达平衡,可用该时刻产物的浓度商Qc与Kc比较大小来判断。
当Qc>kc,υ(正)<υ(逆),未达平衡,反应逆向进行;
当Qc<kc,υ(正)>υ(逆),未达平衡,反应正向进行;
当Qc=kc,υ(正)=υ(逆),达到平衡,平衡不移动。
④平衡常数数值的大小,只能大致告诉我们一个可逆反应的正向反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。如2SO2(g)+O2 2SO3(g) 298K时Kp=3.6×1024很大,但由于速度太慢,常温时,几乎不发生反应。
2SO3(g) 298K时Kp=3.6×1024很大,但由于速度太慢,常温时,几乎不发生反应。
例5: 已知可逆反应CO + H2O(g)  CO2
+ H2,达到平衡时。
CO2
+ H2,达到平衡时。
(1)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,水蒸气的转化率为________;K值为________。
(2)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为______。
(3)若830K时,起始浓度c (CO) = a mol/L,c (H2O) = b mol/L,H2的平衡浓度
c (H2) = c mol/L,①a、b、c之间的关系式是____________________ ;
②当a = b时,a = _____c。
解析(1) CO + H2O(g) CO2 + H2
CO2 + H2
起始浓度(单位均为mol/L) 2 3 0 0
转化浓度 1.2 1.2 1.2 1.2
平衡浓度 0.8 1.8 1.2 1.2
K=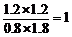
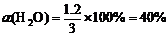
(2)设CO的转化浓度为x CO + H2O(g) CO2 + H2
CO2 + H2
起始浓度(单位均为 mol/L) 2 6 0 0
转化浓度 x x x x
平衡浓度 2 – x 6 – x x x
K =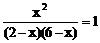 ,x = 1.5 mol/L
,x = 1.5 mol/L 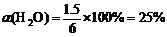
(3) CO + H2O(g) CO2 + H2
CO2 + H2
起始浓度(单位均为mol/L) a b 0 0
转化浓度 c c c c
平衡浓度 a – c b – c c c
① ,②a = b,则a = 2c
,②a = b,则a = 2c
在一定温度下,达到平衡的可逆反应,其平衡常数用生成物平衡浓度(气体平衡分压)的方次之积与反应物平衡浓度(气体平衡分压)的方次之积的比值来表示,这时的平衡常数称为浓度平衡常数(压强平衡常数),用Kc(Kp)表示。
对:aA(g)+bB(g) cC(g)+dD(g),
cC(g)+dD(g),
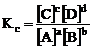
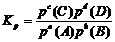
1. 书写平衡常数关系式的规则
①同一化学反应,可以用不同的化学反应式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。平衡常数及单位必须与反应方程式的表示一一对应。
②如果反应中有固体或纯液体参加,它们的浓度不应写在平衡关系式中,因为它们的浓度是固定不变的,化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。
③稀溶液中进行的反应,如有水参加,水的浓度也不必写在平衡关系式中。
如:下列可逆反应的浓度平衡常数的数学表达式
CaCO3(s)  CaO(s)+CO2(g) Kc=[CO2]
CaO(s)+CO2(g) Kc=[CO2]
CO2(g)+H2(g)  CO(g)+H2O(g) Kc=[CO][H2O]/([CO2][H2]
CO(g)+H2O(g) Kc=[CO][H2O]/([CO2][H2]
Cr2O72-+H2O 2CrO42-+2H+ Kc=[CrO42-]2[H+]2/[Cr2O72-]
2CrO42-+2H+ Kc=[CrO42-]2[H+]2/[Cr2O72-]
对于可逆反应: mA(g)+nB (g)  pC(g)+qD(g)。 反应物A的平衡转化率(该条件最大转化率)可表示:
pC(g)+qD(g)。 反应物A的平衡转化率(该条件最大转化率)可表示:
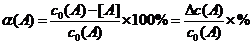
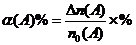
例5:等容积的三个密闭容器中,在一定条件下,甲、乙、丙三容器中分别进行可逆反应:2A(g)+B(g)  3C(g)+2D(g),起始时三个容器中反应物的物质的量(mol)分别如下表所示,在相同条件下,反应物A、B的转化率大小关系为
3C(g)+2D(g),起始时三个容器中反应物的物质的量(mol)分别如下表所示,在相同条件下,反应物A、B的转化率大小关系为
|
反应物 |
甲 |
乙 |
丙 |
|
A |
2 |
1 |
1 |
|
B |
1 |
2 |
1 |
A.A的转化率甲<丙<乙 B.A的转化率甲<乙<丙
C.B 的转化率甲>丙>乙 D.B的转化率甲<乙<丙
解答:对于aA(g)+bB(g)  cC(g)+dD(g)的反应,增大反应物A(g)的浓度,A的转化率减少,B的转化率增大;减少反应物A(g)的浓度,A的转化率增大,B的转化率减少。答案为A、C。
cC(g)+dD(g)的反应,增大反应物A(g)的浓度,A的转化率减少,B的转化率增大;减少反应物A(g)的浓度,A的转化率增大,B的转化率减少。答案为A、C。
2.用K判断平衡移动的方向:可运用浓度商(或压强商)与浓度平衡常数(或压强平衡常数)的大小比较判断:Q<k 平衡向右移动;Q>k平衡向左移动。
对可逆反应:mA(g)+nB (g)  pC(g)+qD(g)
pC(g)+qD(g)
|
条件变化 |
反应特点 |
Q |
k |
Q与k |
移动方向 |
说明 |
|
|
反应物浓度增大 生成物浓度减小 |
QC变小 |
kC不变 |
QC<kC |
向右 |
固体或纯液体参加反应,其浓度视为固定不变的。 |
||
|
生成物浓度增大 反应物浓度减小 |
QC变大 |
kC不变 |
QC>kC |
向左 |
|||
|
升高温度 |
正反应吸热 |
不变 |
变大 |
Q<k |
向右 |
吸热反应K随温度升高增大。放热反应K随温度升高减小。 |
|
|
正反应放热 |
不变 |
变小 |
Q>k |
向左 |
|||
|
降低温度 |
正反应吸热 |
不变 |
变小 |
Q>k |
向左 |
||
|
正反应放热 |
不变 |
变大 |
Q<k |
向右 |
|||
|
压缩体积 增大压强 |
m+n>p+q |
变小 |
不变 |
Q<k |
向右 |
反应物产物都是固体或液体,压强对平衡无影响。 |
|
|
m+n=p+q |
不变 |
不变 |
Q=k |
不移动 |
|||
|
m+n<p+q |
变大 |
不变 |
Q>k |
向左 |
|||
|
容积不变,充入He |
不变 |
不变 |
Q=k |
不移动 |
分压不变 |
||
|
压强不变 充入He |
m+n>p+q |
变大 |
不变 |
Q>k |
向左 |
相当于减压 |
|
|
m+n=p+q |
不变 |
不变 |
Q=k |
不移动 |
|||
|
m+n<p+q |
变小 |
不变 |
Q<k |
向右 |
|||
例3.在下列的平衡系中,所用措施,可使反应向右移动达到新平衡的是( )
A. I-3(aq)  I2 + I-(aq)(加入四氯化碳)
I2 + I-(aq)(加入四氯化碳)
B. H2O( l )
 H2O(g)(加入蔗糖)
H2O(g)(加入蔗糖)
C.Ag+(aq)+ Cl-(aq) AgCl(s)(加入固体AgNO3)
AgCl(s)(加入固体AgNO3)
D.Fe(SCN)2+(aq)  Fe3+(aq) + SCN-(aq)(加入固体NaSCN)
Fe3+(aq) + SCN-(aq)(加入固体NaSCN)
E.BaSO4(s)  Ba2+(aq)+
SO42-(aq)(加入水)
Ba2+(aq)+
SO42-(aq)(加入水)
解析:勒沙特列原理是一个经验性的平衡移动原理,适用于封闭体系,当改变平衡系统的一个条件时,平衡将向减弱这种改变的方向移动。不仅适用于一般的化学平衡,也适用于沉淀溶解平衡、配合平衡、电离平衡、水解平衡等。答案为A、C、E。
例4:T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
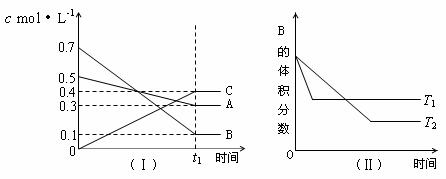
A.在(t1+10)min时,其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向左方向移动
C.T℃时,在相同容器中,若由0.3mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
解析:化学平衡图象题:①一看坐标:一般纵坐标为v、n、c、α、p、φ(百分含量)等,横坐标为t、p、T等;②二看线(线的变化趋势、斜率大小):横坐标为t时图象会出现平台,反映了建立平衡及平衡移动的大致动态变化过程;横坐标为p、T,实际上在考查p、T对化学平衡的影;③三看点(起点、折点、交点、终点)。图Ⅰ是c-t图,根据A、B浓度分别减少0.2 mol·L-1 、0.6 mol·L-1,C的浓度增大0.4 mol·L-1,则反应方程式为A+3B  2C,得出A、D不对。答案为B、C。
2C,得出A、D不对。答案为B、C。
1.化学平衡移动实质:化学平衡移动是由于浓度、温度、压强的变化使可逆反应从一种平衡状态变为另一平衡状态的过程。平衡移动的实质因为条件的变化打破了正反应、逆反应速率相等的关系。υ(正) >υ(逆),正向移动;υ(正)<υ(逆),平衡逆向移动。对可逆反应:mA(g)+nB (g)  pC(g)+qD(g)
pC(g)+qD(g)
|
条件变化 |
反应特点 |
υ(正) |
υ(逆) |
υ正 υ逆 |
移动方向 |
说明 |
|
|
反应物浓度增大 |
增 |
不变 |
υ正 >υ逆 |
向右 |
固体或纯液体浓度视为固定不变的 |
||
|
生成物浓度减小 |
不变 |
减 |
|||||
|
反应物浓度减小 |
减 |
不变 |
υ正< υ逆 |
向左 |
|||
|
生成物浓度增大 |
不变 |
增 |
|||||
|
升高温度 |
正反应吸热 |
增 |
增 |
υ正 >υ逆 |
向右 |
升高或降低温度,υ正 υ逆增加或减小程度不同 |
|
|
正反应放热 |
增 |
增 |
υ正< υ逆 |
向左 |
|||
|
降低温度 |
正反应吸热 |
减 |
减 |
υ正< υ逆 |
向左 |
||
|
正反应放热 |
减 |
减 |
υ正 >υ逆 |
向右 |
|||
|
压缩体积 增大压强 |
m+n>p+q |
增 |
增 |
υ正 >υ逆 |
向右 |
反应物产物都是固体或液体,压强对平衡无影响。 |
|
|
m+n=p+q |
增 |
增 |
υ正= υ逆 |
不移动 |
|||
|
m+n<p+q |
增 |
增 |
υ正< υ逆 |
向左 |
|||
|
容积不变,充入He |
不变 |
不变 |
υ正= υ逆 |
不移动 |
分压不变 |
||
|
压强不变 充入He |
m+n>p+q |
减 |
减 |
υ正< υ逆 |
向左 |
相当于减压 |
|
|
m+n=p+q |
减 |
减 |
υ正= υ逆 |
不移动 |
|||
|
m+n<p+q |
减 |
减 |
υ正 >υ逆 |
向右 |
|||
例2.T℃时,将一定量的混合气体在密闭容器中发生反应aA(g)+bB(g) cC(g)+dD(g),平衡后测得B气体的浓度为0.6mol/L,恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体浓度为0.4mol/L,下列叙述正确的是( )
cC(g)+dD(g),平衡后测得B气体的浓度为0.6mol/L,恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体浓度为0.4mol/L,下列叙述正确的是( )
A.重新达到平衡时,D的体积分数减小 B.a+b<c+d
C.平衡向右移动 D.重新达到平衡时,A气体浓度增大
解析:若平衡不移动,容积扩大1倍,B浓度应为0.3mol/L,说明平衡逆向移动。
答案为A。
3.等效平衡:可逆反应可从左自右达到平衡状态,也可从右向左达到平衡状态,甚至从某一中间过渡状态达到同一平衡状态。条件是对反应前后气体体积变化的反应①同一温度下、体积不变时,反应混合物的组成经过转换实质上是相同的。②同一温度下、压强不变时,反应混合物经过转换在组成比例上是相同的。③对反应前后气体体积不变的反应,恒温恒容或恒温恒容条件下,只要反应混合物组成比例上相同的,平衡均可达到等效。
例1.在一定条件下,在固定容积的密闭容器中,能表示反应X(气)+2Y(气) 2Z(气)一定达到化学平衡状态的是( )
2Z(气)一定达到化学平衡状态的是( )
A.容器内压强不随时间改变 B.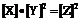
C.正反应生成Z的速率与逆反应生成Y的速率相等
D.容器内混合气体的密度不随时间改变
E.X、Y、Z的物质的量之比 1:2:2
F.一定温度下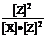 为一常数
为一常数
解析:化化学平衡的特征是①平衡混合物各性质(如颜色、浓度、密度)不再改变,②正反应速率和逆反应速率相等,但反应继续进行,为动态平衡。③生成物平衡浓度的方次之积与反应物平衡浓度的方次之积的比值为一常数。答案为A、C、D、F。
2.化学平衡状态与化学平衡常数的关系:一个反应在同一温度下,可有不同的化学平状态,但平衡常数只有一个,即平衡时各物质的浓度关系只有一个。
1.在一定温度的密闭容器中,可逆反应进行一段时间后,会达到平衡状态。此时正反应速率和逆反应速率相等,反应体系的组成不再随时间的延续而变化,化学反应达到一定的限度。化学平衡是动态平衡。外界条件的变化会导致平衡发生移动。
6.化学反应条件的优化-工业制备硫酸
工业制备硫酸的过程中,关键是怎样把SO2尽可能快尽可能多地转化为SO3。
2SO2(g) + O2(g)  2SO3(g) ΔH = -196.6kJ·mol-1
2SO3(g) ΔH = -196.6kJ·mol-1
⑴温度:400-500℃。从速率分析温度越高越好;从平衡分析温度越低越好。因此综合分析同时考虑到催化剂的活性,选择温度在400-500℃左右。
⑵压强:常压。从速率和平衡分析,压强越大,对生成SO3越有利。但压强越大,对设备的强度要求越高。同时,考虑到常压下SO2转化SO3的产率已可达到90%多,因此没有必要再加压。
⑶催化剂:V2O5 。由于该反应即使在较高的温度下,也难于进行。因此为了提高单位时间SO3的产量,目前工业上采用V2O5作催化剂。
⑷浓度:适当增大SO2特别是O2(即空气)浓度。适当增大SO2和O2浓度,有利于反应向生成SO3的方向移动。(注意:合成SO3过程中,不需要分离出SO3。这是由于在合成SO3过程中,SO2已基本转化为SO3,达平衡后SO2剩余量少。)
⑸投料比:过量空气。生产中使廉价易得的原料(空气)过量,可提高另一原料(SO2)的利用率,从而降低生产成本。因此,在二氧化硫的氧化过程中要通过量空气。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com