
与其它平衡相同,弱电解质在中达到电离平衡时电离程度的大小主要由电解质本身的性质决定,同时受到外界条件的影响。电离过程的热效应较小,在温度变化不大的情况下,一般不考虑温度对电离平衡的影响。若温度升高较多时,电离程度增强,离子浓度增大。
在一定温度下,稀释溶液,弱电解质电离程度增强,离子数目增多,但由于溶液体积增大而离子浓度降低。当加入含有弱电解质组成的相同的离子时,弱电解质的电离平衡向左移动。
对CH3COOH H++CH3COO-的电离平衡,小结如下:
H++CH3COO-的电离平衡,小结如下:
|
条件变化 |
平衡移动 |
电离度 |
K |
离子数目 |
离子浓度 |
|
加热 |
正向移动 |
增大 |
增大 |
增多 |
增大 |
|
稀释 |
正向移动 |
增大 |
不变 |
增多 |
减小 |
|
加冰醋酸 |
正向移动 |
减小 |
不变 |
增多 |
增大 |
|
加盐酸 |
逆向移动 |
减小 |
不变 |
H+ 增多 CH3COO-减少 |
|
|
加醋酸钠 |
逆向移动 |
减小 |
不变 |
H+ 减少 CH3COO-增多 |
例1:在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如右图所示。请回答:

 (1)“O”点导电能力为“0”的理由是
(1)“O”点导电能力为“0”的理由是
___________ ______。
(2)A、B、C三点pH值由大到小的顺序是
_______________________。
(3)A、B、C三点电离程度最大的是____________
解析:溶液的导电能力取决于离子浓度的大小,C点离子浓度最小,
加水量最多,电离程度最大。
答案(1)“O”点时醋酸尚未电离; (2)C>A>B(3)C
3.酸、碱混合溶液pH的计算
(1)两种强酸稀溶液混合
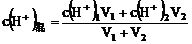
(2)两种强酸稀溶液混合
(3)酸碱稀溶液混合,酸过量
(4)酸碱稀溶液混合,碱过量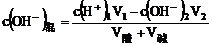
例2:将pH=9的NaOH与pH=11的NaOH溶液等体积混合后,溶液的[H+]为( )mol/L
A. 1/2(10-9+10-11) B.1/2(10-5+10-3)
C. 2×10-11 D.1/2 ×10-3
解析:[OH-] =(10-5+10-3)/2= 5×10-4 mol/L, [H+]=2×10-11 mol/L ,选C.
例3:25ºC,若10体积的某强酸溶液与1体积的某强碱溶液混合后,溶液呈中性,则混合之前,该碱的pH与强酸的pH之间该满足的关系是_______________________
解析: 混合后溶液呈中性,说明10·[H+]a = 1·[OH-]b, 则 10[H+]a = 1×10-14/[H+]b
[H+]a = 1×10-15/[H+]b [H+]a· [H+]b = 1×10-15 , 答案为pHa+pHb=15。
2.溶液的稀释pH的计算
(1)对于强碱溶液c (OH-) 每稀释10n倍, pH减小n个单位(减小后不超过7)。
(2)对于强酸溶液c (H+) 每稀释10n倍, pH增大n个单位(增大后不超过7)。
(3)pH相同的强酸与弱酸,当稀释相同倍数时,强酸变大的程度比弱酸大。
(4)pH相同强碱与弱碱,当稀释相同倍数时,强碱变小的程度比弱碱大。
1.单一溶液pH的计算
(1)强酸pH的计算:强酸HnA,浓度为c mol·L-1
则c (H+) =nc mol·L-1, pH=-lg[H+]=-lgnc
(2)强碱pH的计算:强碱B(OH)n,设浓度为c mol·L-1
则[H+] =10-14 / nc , pH=-lg[H+]=14 + lgnc
(3)弱酸pH的计算(只作了解):弱酸HA,浓度为c mol·L-1
则[H+] =cαmol·L-1, pH=-lg[H+]=-lgcα
(4)弱碱pH的计算(只作了解):强碱BOH,设浓度为c mol·L-1
则[H+] =10-14 / cα , pH=-lg[H+]=14 + lgcα
2. 酸碱盐对水的电离平衡的影响
酸碱盐对水的电离平衡的影响


1.温度
由于水电离过程为吸热过程,升温将促进水的电离,平衡右移,Kw变大,c (H+) 、c (OH-) 也同时增大,pH变小,但由于c (H+)与c (OH-) 始终保持相等,故仍显中性。
水能发生微弱的电离,且水的电离是一个可逆过程。在一定温度下达到电离平衡,[H+][OH-]=Kc[H2O]=Kw,一定温度时Kc、[H2O]均为常数,Kc[H2O]=Kw是一个常数,Kw简称水的离子积。250C时,水的离子积为1.0×10-14 mol2·L-2。
例1:某温度下纯水中C(H+) = 2.0×10-7 mol/L,则此时溶液中的C(OH-) = __________。 若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = _____。
解析:纯水中C(OH-) =C(H+) =2×10-7 mol/L,则该温度下水的离子积为4×10-14 mol2·L-2。当C(H+) = 5×10-6 mol/L时,C(OH-) = 8×10-9 mol/L。
|
条件 |
提高平衡 转化率 |
提高化学反应速率 |
其它因素 |
适宜条件 |
|
温度 |
低温有利 |
高温有利 |
催化剂活性 |
反应温度在700K左右 |
|
压强 |
加压有利 |
加压有利 |
反应器材质要求 |
一般为20MPa- 50MPa |
|
浓度 |
原料气压缩并循环使用 |
及时将氨气移走 |
N2:H2 的分压为1:2.8投料比,循环使用N2 H2,迅速冷却,氨气液化移走 |
|
|
催化剂 |
防止催化剂中毒 |
研制优良的催化剂 |
催化剂对H2的吸附能力强于N2 |
以铁为主体的多成分催化剂 |
4. Kc与Kp的关系
对于反应:mA(g)+nB(g) pC(g)+qD(g) 若(p+q)-(m+n)=△n
pC(g)+qD(g) 若(p+q)-(m+n)=△n
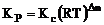
3. 平衡常数的组合(多重平衡规则): 如果某个反应可以表示为两个或多个反应的总和,则总反应的平衡常数等于各分步反应平衡常数之积。
例6:已知(1) 2H2O(g) 2H2(g)+O2(g) K1,(2) 2CO2(g)
2H2(g)+O2(g) K1,(2) 2CO2(g) 2CO(g)+O2 K2
2CO(g)+O2 K2
试求:(3)CO2(g)+H2(g) CO(g)+H2O(g)
K3
CO(g)+H2O(g)
K3
(4)CO(g)+H2O(g) CO2(g)+H2(g) K4的平衡常数K3和K4
CO2(g)+H2(g) K4的平衡常数K3和K4
解析: 规律如下:“方程式倒写,K倒数;方程式相加,K相乘;方程式×n倍,K则n次方”。答案为 、
、
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com