
例1. 常温下,已知0.1mol/L的NaX、NaY、NaZ溶液,其pH值分别为8、9、10,则HX、HY、HZ的酸性强弱排列正确的
A.HX>HY>HZ B.HY>HX>HZ C.HZ>HY>HX D.HZ>HX>HY
解:酸越弱,阴离子的水解程度越大,溶液的pH越大,根据pH的大小可推知Z-水解程度最大,HZ的酸性最弱,而HX的酸性最强,则三种酸的酸性由强到弱的顺序为HX>HY>HZ。 答案为:A
例2.一定温度下,物质的量浓度均为0.1mol/L的下列溶液中①NH4Cl ②NH4HSO4 ③(NH4)2CO3 ④(NH4)2SO4,c(NH4+)由大到小排列___________________________。
解:③、④比较,(NH4)2CO3中的CO32-水解呈碱性,促进了NH4+的水解,故c(NH4+):④>③;
①、②中NH4HSO4电离出来的H+抑制了NH4+的水解,故c(NH4+):①<②。
答案为: ④>③>②>①
例3.将0.1mol/L的AlCl3溶液加热、蒸干、灼烧最后得到的固体是( )
A Al BAl(OH)3 C AlCl3 D Al2O3
解:加热可促进盐的水解,由于HCl挥发,可使水解进行彻底,得到Al(OH)3沉淀,Al(OH)3
灼烧分解,最终产物为Al2O3。
答案为D。
例4.配置BiCl3溶液时有水解产物BiOCl生成而溶液呈浑浊现象。
(1)写出发生该现象的反应的方程式______________________。
(2)医药上常将BiOCl称为次氯酸铋,该名称__________(正确、不正确)。
(3)如何配置BiCl3溶液___________________________________________________。
解:BiCl3溶液中,Bi3+对应的碱Bi(OH)3是弱碱,它水解生成BiOCl,反应的方程式:
BiCl3 + H2O=BiOCl¯+2HCl;在BiOCl中,Cl的化合价为-1价,而次氯酸盐中Cl的化合价应为+1价,故BiOCl不是次氯酸铋;配置BiCl3溶液时由于BiCl3的强烈水解,所以要抑制其水解,具体操作是将适量BiCl3固体溶解在少量浓盐酸中,然后加水稀释。
答案:(1)BiCl3 + H2O=BiOCl¯+2HCl;(2)不正确;(3)BiCl3溶液的配置:将适量BiCl3固体溶解在少量浓盐酸中,然后加水稀释。
例5.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H+
+ OH-,
HB-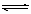 H+ + B2-
H+ + B2-
回答下列问题:
(1)Na2B溶液显____________(填“酸性”,“碱性”,“中性”)。理由是_______________(用离子方程式表示)。
(2)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L a+)+c(OH-)=c(H+)+ c(HB-)
a+)+ c(H+)= c(OH-)+ c(HB-)+2c(B2-) a+)=2c(B2-)+2 c(HB-)
(3)已知0.1mol/LNaHB溶液的pH=2,则0.1mol/LH2B溶液中c(H+)___________0.11mol/L(填“>”“<”“=”)。HB-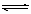 H+ + B2-的电离平衡常数是________________。
H+ + B2-的电离平衡常数是________________。
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
解:(1)H2B=H+
+ OH-(完全电离), HB-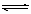 H+ + B2-(部分电离),所以盐中HB-不水解,B2-水解,故Na2B显碱性。离子方程式:B2-+H2O
H+ + B2-(部分电离),所以盐中HB-不水解,B2-水解,故Na2B显碱性。离子方程式:B2-+H2O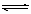 HB-+OH-。
HB-+OH-。
(2)在0.1mol/Na2B溶液中由物料守衡得:c(Na+)=2c(B2-)+2 c(HB-)=0.2mol/L。由电荷守衡得:
c(Na+)+c(H+)=2c(B2-)+ c(OH-)+ c(HB-)。故答案为CD。
(3)已知0.1mol/LNaHB溶液的pH=2,说明c(H+)=0.01mol/L,NaHB电离为主。在H2B溶液中,第一步电离的H+抑制了第二步电离,所以0.1mol/L的H2B溶液中的c(H+)<0.11mol/L。
在0.1mol/LNaHB溶液达到电离平衡时,溶液中的离子平衡浓度:c(H+)= c(B2-)=0.01 mol/L, c(HB-)=0.1mol/L-0.01mol/L=0.09mol/L,根据电离平衡常数的定义知:
Ka=0.012/0.09=1.11×10-3。
(4)在NaHB溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(HB-)>c(H+)>c(B2-)> c(OH-)。
答案:(1)碱性,B2-+H2O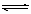 HB-+OH-;(2)CD;(3)<,第一步电离的H+抑制了第二步电离,Ka==1.11×10-3;(4)c(Na+)>c(HB-)>c(H+)>c(B2-)>
c(OH-)。
HB-+OH-;(2)CD;(3)<,第一步电离的H+抑制了第二步电离,Ka==1.11×10-3;(4)c(Na+)>c(HB-)>c(H+)>c(B2-)>
c(OH-)。
2.考虑水解反应的常见情况
由于水解是微弱的,所以通常情况下不考虑它的影响,但遇到下列情况时必须考虑。
(1)物质的制备有时要考虑盐类水解,如用饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体。
(2)物质鉴别时要考虑盐类水解,如用pH试纸或酚酞溶液鉴别NaCl与NaAC两种水溶液。
(3)配置盐溶液时要考虑盐类水解,如配置Fe2(SO4)3、SnCl2等溶液时要加硫酸和盐酸。
(4)比较盐溶液中离子浓度大小时要考虑盐类水解,如Na2CO3溶液中离子浓度大小排列。
(5)用盐作净水剂,如明矾净水要考虑盐类水解。
(6)化肥合理施用要考虑盐类水解,如草木灰(含K2CO3水解碱性)不要和过磷酸钙(主要含Ca(H2PO4)2酸性)及铵态氮肥(NH4NO3水解酸性)等混合施用。
(7)判断盐溶液的酸碱性时要考虑盐类水解,如Na2CO3溶液水解显碱性,Al2(SO4)3溶液水解显酸性等。
(8)制备某些盐时要考虑盐类水解,如制备Al2S3、无水MgCl2等。
(9)判断酸碱中和滴定终点溶液的酸碱性时要考虑盐类水解。
(10)强酸弱碱盐与强碱弱酸盐溶液混合要考虑盐类水解,如AlCl3与Na2CO3、FeCl3与NaClO两溶液混合发生双水解反应。
1.盐类水解应用十分广泛,它包括:(1)混施化肥;(2)泡沫灭火器;(3)明矾净水;(4)FeCl3溶液止血;(5)判断溶液的酸碱性;(6)比较离子浓度大小;(7)判断离子共存;(8)制备胶体;
(9)盐溶液的配置;(10)物质的制备;(11)试剂的保存;(12)物质的鉴别等。
2.外因:受温度、浓度及外加酸碱的影响。
①温度的影响:盐的水解方向是吸热反应,升高温度可促进水解,水解平衡向右移动,使水解程度增大。
②盐的浓度的影响:将盐溶液加水稀释,水解平衡向右移动,使水解程度(水解度)增大;增大盐的浓度,水解平衡向右移动,但盐的水解程度(水解度)却变小。
③溶液的酸碱度:盐溶液加酸(H+)可抑制阳离子的水解,促进阴离子水解;盐溶液加碱(OH-)可抑制阴离子的水解,促进阳离子水解。
1.内因:盐本身的性质,组成盐的弱酸根对应的酸越弱(或组成盐的阳离子对应的碱越弱),水解程度越大。
3.盐类水解方程式的书写
(1)
盐类水解程度一般微弱,方程式要用可逆号“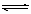 ”表示,产物中的弱电解质不标“¯”或“”,也不写成分解产物的形式。
”表示,产物中的弱电解质不标“¯”或“”,也不写成分解产物的形式。
如:NH4+
+H2O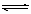 NH3·H2O+ H+ HCO3- + H2O
NH3·H2O+ H+ HCO3- + H2O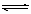 H2CO3 Fe3++3H2O
H2CO3 Fe3++3H2O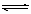 Fe(OH)3+3H+
Fe(OH)3+3H+
(2) 多元弱酸盐的水解方程式要分步写。
如Na2CO3溶液:CO32-+H2O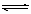 HCO3- HCO3-
+ H2O
HCO3- HCO3-
+ H2O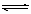 H2CO3
H2CO3
(3) ①双水解反应能进行到底的要用“=”,产物中的沉淀、气体要标“¯”和“”。
如明矾和小苏打两溶液混合: Al3++3HCO3-=Al(OH)3¯+3CO2
如硫化铝在水中的反应:Al2S3+6H2O=2Al(OH)3¯+3H2S
②醋酸铵也能发生双水解反应,但不能进行到底,无气体、沉淀产生,以NH4+、CH3COO-、NH3·H2O、CH3COOH共存,方程式要用可逆号“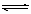 ”表示,产物中的弱电解质不标“¯”或“”。
”表示,产物中的弱电解质不标“¯”或“”。
醋酸铵的水解离子方程式:NH4++CH3COO-+H2O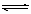 NH3·H2O+CH3COOH
NH3·H2O+CH3COOH
2.盐类水解规律
有弱才水解,无弱不水解;越弱越水解,都弱双水解;谁强显谁性,同强显中性。
|
盐的类型 |
实例 |
是否水解 |
离子的水解 |
溶液的pH |
|
强酸强碱盐 |
NaCl、KNO3 BaCl2 |
不水解 |
|
pH=7 |
|
强酸弱碱盐 |
NH4Cl、CuSO4 Fe(NO3)3 |
水解 |
NH4+、Cu2+ Fe3+ |
pH<7 |
|
强碱弱酸盐 |
KClO、Na2S NaHCO3 |
水解 |
ClO-、S2- HCO3- |
pH>7 |
(1)组成盐的弱碱阳离子(M+)能水解显酸性,组成盐的弱酸阴离子(A-)能水解显碱性。
M+ +
H2O 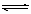 MOH + H+
A- + H2O
MOH + H+
A- + H2O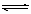 HA + OH-
HA + OH-
(2)盐对应的酸(或碱)越弱,水解程度越大(越弱越水解),溶液碱性(或酸性)越强。
(3)多元弱酸根,正酸根离子比酸式弱酸根离子水解程度大得多,如:CO32-比HCO3-的水解程度大得多,溶液的碱性更强。
(4)弱酸弱碱盐的阴阳离子能双水解,水解程度比单一离子水解程度大,溶液的酸碱性是“谁强显谁性”如:NH4Ac溶液显中性,而(NH4)2S溶液显碱性。
完全双水解的例子:Al3+与CO32-、HCO3-、S2-、HS-、[Al(OH)4]-、ClO-、SiO32-、PO43-、HPO42-等离子发生完全双水解;Fe3+(Fe2+)与CO32-、HCO3-、[Al(OH)4]-、ClO-、SiO32-、PO43-、HPO42-等离子发生完全双水解;NH4+与SiO32-、[Al(OH)4]-等离子发生完全双水解。
1.盐类的水解
(1)水解反应的概念:水溶液中盐的离子与水电离出的H+或OH-结合生成弱电解质的反应。
(2)水解的实质:水解反应破坏了水的电离平衡;促进了水的电离。
(3)水解的条件:①盐必须溶于水中;②盐中必须有弱酸根离子或弱碱阳离子(有弱才水解)。
(4)水解特征:水解属可逆反应,逆反应是中和反应,因此水解方程式要用可逆号“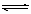 ”。
”。
2、碱:电离时生成的阴离子全部是氢氧根离子的化合物
1、酸:电离时生成的阳离子全部是氢离子的化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com