
1、 中和滴定原理(对于强酸、强碱溶液的滴定反应):
强酸与强碱溶液之间的中和反应的实质是:H+ + OH- = H2O , 所以:n(H+) = n(OH-),
即:c(H+)V(H+)=c(OH-)V(OH-),可写成: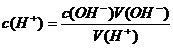
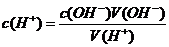 或:
或:
由上式可知:用已知浓度的强酸(或强碱)与未知浓度的强碱(或强酸)反应,如果测出恰好中和时二者的体积,即可由上式计算出未知液的浓度。
3、滴定法的综合应用。
[要点精析]
2、掌握酸碱中和滴定的简单计算。
1、了解酸碱中和滴定基本操作方法、误差分析等。
0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42-中哪种离子先沉淀?
(2)当刚出现Ag2CrO4沉淀时,溶液中的Cl-离子浓度是多少? CrO42-与Cl-能否达到有效的分离?(当一种离子开始沉淀时,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离).
解:(1)当溶液中某物质离子浓度的乘积大于Ksp时,会形成沉淀。
AgCl饱和所需Ag+浓度[Ag+]1=1.8×10-7摩/升
Ag2CrO4饱和所需Ag+浓度[Ag+]2= =4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2)由Ag2CrO4沉淀时所需Ag+浓度求出此时溶液中Cl-的浓度可判断是否达到有效分离。
=4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2)由Ag2CrO4沉淀时所需Ag+浓度求出此时溶液中Cl-的浓度可判断是否达到有效分离。
Ag2CrO4开始沉淀时[Cl-]=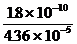 =4.13×10-6<10-5,所以能有效地分离。
=4.13×10-6<10-5,所以能有效地分离。
2.沉淀的转化
沉淀的转化是一种难溶电解质转化为另一种难溶电解质的过程,其实质是沉淀溶解平衡的移动。难溶物的溶解度相差越大,这种转化的趋势越大。
如:在AgCl(s)中加入足量的NaBr溶液,白色AgCl(s)可全部化为淡黄色AgBr(s), 在AgBr(s)中加入足量的NaI 溶液,淡黄色AgBr(s)可全部化为黄色的AgI(s);
AgCl、AgBr、AgI的Ksp逐渐减小,白色AgCl沉淀转化成难溶的淡黄色的AgBr,然后淡黄色的AgBr再转变成更难溶的黄色AgI沉淀。
离子方称式:AgCl+Br-=AgBr+Cl-, AgBr+I-=AgI+Br-.
在ZnS沉淀上滴加CuSO4溶液白色ZnS(s)转化为黑色的CuS沉淀,ZnS+Cu2+CuS+Zn2+;
因为FeS、MnS 、 ZnS的Ksp远小于CuS、HgS、PbS的Ksp,利用沉淀转化原理,在工业废水的处理过程中,常用FeS(s) 、MnS(s) 、ZnS等难溶物作为沉淀剂除去废水中的Cu2+、Hg2+、Pb2+等重金属离子。
例3: 已知,Ksp[FeS]= 6.3×10-18, Ksp[CuS]= 1.3×10-36 ,Ksp[MnS]= 2.5×10-13 ,
Ksp[HgS]= 6.4×10-53,判断下列离子方称式不正确的是
A.FeS(s) + Cu2+(aq)= CuS(s) +Fe2+ (aq) B.FeS(s) +Hg2+(aq) = HgS(s) +Fe2+(aq)
C.HgS(s) + Fe2+(aq) = FeS(s) +Hg2+(aq) D.FeS(s)+Mn2+(aq)=MnS(s)+Fe2+(aq)
解:可以比较Ksp的大小来判断离子方称式是否正确, Ksp[FeS]> Ksp[CuS], Ksp[FeS]> Ksp[HgS],AB正确,CD不正确.
也可以通过求每个离子反应的平衡常数K,当平衡常数K>1.0×105,离子反应可进行, 当平衡常数K<1.0×10-5时, 离子反应不能发生.
K(A)=Ksp(FeS)/Ksp(CuS)= 6.3×10-18/1.3×10-36=2.0×1017>>1.0×105,A反应正确;
K(B)=Ksp(FeS)/Ksp(HgS)= 6.3×10-18/6.4×10-53=1.0×1035>>1.0×105,B反应正确;
K(C)=Ksp(HgS)/Ksp(FeS)= 6.4×10-53/6.3×10-18=1.0×10-35 <<1.0×10-5,B反应不发生;
K(D)= Ksp(FeS)/Ksp(MnS)= 6.3×10-18/2.5×10-13=2.5×10-5 <1.0×10-5,B反应不发生;
答案:CD
例4:已知常温下,Mg(OH)2在水中的溶解度为6.38×10-3g/L,求
(1)Mg(OH)2饱和溶液中的溶度积Ksp。
(2)求Mg(OH)2在0.001mol/L的NaOH溶液中的溶解度。
(3)求Mg(OH)2在0.001mol/L的MgCl2溶液中的溶解度。
解:(1)Mg(OH)2在水中的溶解度为6.38×10-3g/L,即Mg(OH)2物质的量浓度=6.38×10-3g/L¸58g/mol=1.1×10-4mol/L,[Mg2+]=1.1×10-4mol/L,[OH-]=2.2×10-4mol/L,
Ksp=[Mg2+][OH-]2=1.1×10-4×(2.2×10-4)2=5.3×10-12
(2)[OH-]=0.001mol/L,[Mg2+]=Ksp/[OH-]2=5.3×10-12/(0.001)2=5.3×10-6(mol/L)
=3.07×10-4g/L.
溶解度为5.3×10-6mol/L或3.07×10-4g/ L或3.07×10-5g.
(3)[OH-]=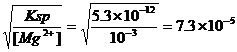 mol/L,
mol/L,
Mg(OH)2物质的量浓度=1/2×7.3×10-5mol/L=3.6×10-5mol/L, 溶解度为3.6×10-5mol/L
或2.1×10-3g/ L或2.1×10-4g.
例5:已知Ksp(AgCl)=1.8×10-1 0,Ksp(Ag2CrO4)=1.9×10-12,现有0.001摩/升AgNO3溶液滴定
1.沉淀的溶解与生成
利用溶度积KSP可以判断沉淀的生成、溶解情况以及沉淀溶解平衡移动方向。
a.当 Qc > Ksp时是过饱和溶液,反应向生成沉淀方向进行,直至达到沉淀溶解平衡状态(饱和为止)。
b.当 Qc = Ksp时是饱和溶液,达到沉淀溶解平衡状态。
c.当 Qc < Ksp时是不饱和溶液,反应向沉淀溶解的方向进行,直至达到沉淀溶解平衡状态(饱和为止)。
以上规则称为溶度积规则。沉淀的生成和溶解这两个相反的过程它们相互转化的条件是离子浓度的大小,控制离子浓度的大小,可以使反应向所需要的方向转化。
(1).沉淀的溶解
①酸溶解法
如BaCO3(s)等难溶盐可溶解在酸溶液中,不能内服BaCO3(s)作钡餐,而应用BaSO4(s)。
BaCO3(s) +2H+=CO2+H2O+Ba2+
由于酸电离出的H+与BaCO3(s)中溶解产生的 CO32-反应生成CO2和水,使CO32-离子浓度降低,离子的浓度商Qc < Ksp,BaCO3的沉淀溶解平衡向右移动,最后BaCO3溶解在过量的酸溶液中。
②氧化还原溶解法
如金属硫化物FeS(s) 、MnS(s) 、ZnS不溶于水但可溶于酸中,而CuS、Ag2S、HgS等不溶于水也不溶于酸,只能溶于氧化性酸HNO3溶液中。S2-被氧化,离子的浓度商Qc < Ksp,沉淀溶解平衡向右移动,最后CuS、Ag2S、HgS溶解在HNO3溶液中。
3CuS+2NO3-+8H+=3Cu2++3S↓+2NO↑+4H2O
③生成配合物溶解法
如AgCl、Cu(OH)2可溶解在氨水中生成银氨溶液和铜氨溶液等更稳定配离子,减少了Ag+和Cu2+的浓度,使得离子的浓度商Qc < Ksp,沉淀溶解平衡向右移动,最后AgCl、Cu(OH)2溶解在氨水中。
AgCl+2NH3=[Ag(NH3)2]++Cl- Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
(2).沉淀的生成
①溶洞中石笋的生成;②珊瑚的生成;③水垢的形成;④在MgCl2等盐溶液中滴加NaOH等碱性溶液产生Mg(OH)2等沉淀。Mg2++2OH-=Mg(OH)2↓ Fe3++3OH-=Fe(OH)3↓
由于盐电离出的金属阳离子Mg2+与碱电离出的OH-离子的浓度商Qc > Ksp,反应向生成Mg(OH)2沉淀方向进行,直至达到沉淀溶解平衡状态(饱和为止)。
例2:已知氨水的Kb=1.8×10-5,Ksp[Mg(OH)2]= 5.6×10-12, (1).在100mL0.001mol/L的MgCl2溶液中加入等体积和0.01mol/L的NaOH溶液,是否有沉淀析出?(2) 在100mL0.01mol/L的MgCl2溶液中加入等体积和0.01mol/L的氨水溶液,是否有沉淀析出?
解:(1)Qc=[Mg2+][OH-]2=5.0×10-4×(5.0×10-3)2=1.25×10-8, Qc >Ksp[Mg(OH)2],有Mg(OH)2沉淀析出.
(2)氨水是弱碱混合后电离出的[OH-]=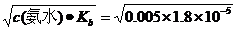 =3.0×10-4,
=3.0×10-4,
Qc=[Mg2+][OH-]2=5.0×10-4×(3.0×10-4)2=4.5×10-12, Qc <Ksp[Mg(OH)2],无Mg(OH)2沉淀析出.
3.溶度积KSP的性质
(1)溶度积KSP的大小和平衡常数一样,它与难溶电解质的性质和温度有关,与浓度无关,离子浓度的改变可使溶解平衡发生移动,而不能改变溶度积KSP的大小。
(2)溶度积KSP反映了难溶电解质在水中的溶解能力的大小。相同类型的难溶电解质的Ksp越小,溶解度越小,越难溶于水;反之Ksp越大,溶解度越大。
如:Ksp(AgCl)= 1.8×10-10 ;Ksp(AgBr) = 5.0×10-13;Ksp(AgI) = 8.3×10-17.
因为:Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI),所以溶解度:AgCl) > Ksp (AgBr) > Ksp (AgI)。
不同类型的难溶电解质,不能简单地根据Ksp大小,判断难溶电解质溶解度的大小。
例1:Ksp[Mg(OH)2]= 5.6×10-12, Ksp(AgCl) =1.8×10-10
解:不能由此判断Mg(OH)2的比AgCl更难溶于水。而要通过计算比较Mg2+与Ag+浓度的大小或求二者的溶解度的大小来判断。
设Mg(OH)2的饱和溶液中[Mg2+]为x,[OH-]=2x;AgCl的饱和溶液中[Ag+]=[Cl-]=y
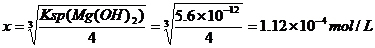
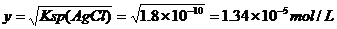
因为:x>y,所以:AgCl 比Mg(OH)2更难溶。
也可进一步求出它们的溶解度,在Mg(OH)2和AgCl的饱和溶液中,溶液的浓度很小,其密度均取1,所以溶解度:
s(Mg(OH)2)=58×1.12×10-4×1000/100=6.50×10-4(g)
s(AgCl)=143.5×1.34×10-5×1000/100=1.92×10-4(g) ,
溶解度:Mg(OH)2>AgCl。
2.溶度积常数Ksp(或溶度积)
难溶固体在溶液中达到沉淀溶解平衡状态时,离子浓度保持不变(或一定)。各离子浓度幂的乘积是一个常数,这个常数称之为溶度积常数简称为溶度积,用符号Ksp表示。
即:AmBn(s) mAn+(aq)+nBm-(aq) Ksp
=[An+]m·[Bm-]n
mAn+(aq)+nBm-(aq) Ksp
=[An+]m·[Bm-]n
例如:常温下沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq),
Ag+(aq)+Cl-(aq),
Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10
常温下沉淀溶解平衡:Ag2CrO4(s) 2Ag+(aq)+CrO42-(aq),
2Ag+(aq)+CrO42-(aq),
Ksp(Ag2CrO4)=[Ag+]2[CrO2- 4] =1.1×10-12
1. 沉淀溶解平衡
一定温度下,难溶电解质AmBn(s)难溶于水,但在水溶液中仍有部分An+和Bm-离开固体表面溶解进入溶液,同时进入溶液中的An+和Bm-又会在固体表面沉淀下来,当这两个过程速率相等时,An+和Bm- 的沉淀与AmBn固体的溶解达到平衡状态,称之为达到沉淀溶解平衡状态.
AmBn固体在水中的沉淀溶解平衡可表示为:AmBn(s) mAn+(aq)+nBm-(aq)
mAn+(aq)+nBm-(aq)
难溶电解质在水中建立起来的沉淀溶解平衡和化学平衡、电离平衡等一样,合乎平衡的基本特征,满足平衡的变化基本规律.
特征:(1)逆:可逆过程;(2)等:沉积和溶解速率相等;(3)动:动态平衡;(4)定:离子浓度一定(不变);(5)变:改变温度、浓度等条件,沉淀溶解平衡会发生移动直到建立一个新的沉淀溶解平衡。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com