
3.特点
⑴ 组成特点:除碳元素外,还含有H、O、N、P、S及卤素等非金属元素;
⑵ 结构特点
① 碳碳键以共价键形成碳链,这是有机物结构的基础;
② 有机物分子多为非极性分子或弱极性分子;
③ 有机物分子间通过范得华力结合成分子晶体;
⑶ 数量特点:
有机物的种类繁多,达数千万种,其主要原因是:
① 碳原子有四个价电子,能与其他原子形成4个共价键;
② 碳链的长度可以不同;碳原子之间的结合方式可以有单键、双键、叁键,也可以有长链或环状等;
③ 普遍存在同分异构现象;
⑷ 性质特点:(对于大多数有机物)
① 难溶于水,易溶于汽油、酒精、苯等有机溶剂;
② 多为非电解质,不易导电;
③ 多数熔、沸点较低;
④ 多数易燃烧,易分解;
⑸ 反应特点:
有机反应复杂,速率慢,多数需要催化剂,而且副反应多,所以有机反应方程式常用“→”表示,而不用“=”表示;
2.有机物的概念
除CO、CO2、H2CO3、碳酸盐、酸式碳酸盐及金属碳化物外,含有碳元素的化合物叫有机化合物,简称有机物;
1.有机化学的发展
萌芽于17世纪,创立并成熟于18、19世纪。20世纪发展成为一门内容丰富、涵盖面广、充满活力的学科。21世纪又进入新的发展阶段。
瑞典化学家贝采里乌斯首先提出“有机化学”和“有机化合物”概念。
青出于蓝胜于蓝,1828年德国化学家维勒通过加热NH4CNO制得尿素这一反应否定了贝采里乌斯提出的有机物得自天然,只能提取,不能合成的观点,使人类由提取有机物进入合成有机物的新时代。
创立有机化合物定量分析方法的是德国化学家李比希。
迄今为止已知的3700多万种化合物中,有机化合物已经超过3000万种。
1965年我国成功地在世界上首次用化学方法实现了具有生物活性的蛋白质―-牛胰岛素的合成,为人工合成蛋白质迈出了极为重要的一步。
2、 物质变化的反应式
(1) 化学方程式:以分子式(化学式)表示化学反应的式子。
原则:要遵循客观存在的事实;要遵循质量守恒定律。
含义:
①表示参加反应的反应物与生成物
②表示参加反应的反应物与生成物的微粒数之比
③表示反应中反应物与生成物的质量比
④若各物质为气态时,还表示反应中反应物与生成物的体积比(相同条件)。
注意:I、表明反应所需的条件;
II、一般化学反应用“=”表示。若是可逆反应则用“≒”表示。如水解、弱电质的电离等,若是有机物参加的反应则用“→”表示。
III、化学方程式配平的方法有如下几种:
① 观察法②奇数配偶数法③最小公倍数④氧化还原反应可用化合价升降法
(详见氧化还原方程式的配平)。
1、 化学符号
(1) 元素符号、核组成符号、原子和离子的结构示意图
|
元素符号 |
核组成符号 |
原子和离子结构示意图 |
||
|
氯元素“Cl”、 铜元素“Cu” |
X-元素符号
Z-质子数 如:12 6C |
 |
每种元素符号都包括了三种含义:①表示元素的种类,②表示元素的一个原子,③表示元素的相对原子质量。
要准确记住七个主族元素的符号和一些常见的过渡元素的符号,如:Ti、V、Cr、Mn、Fe、Co、Ni、Zn、Cu、Ag、Au、He、Ne、Ar、Kr。书写元素符号一定要规范。
核组成符号的写法是,在元素符号左下角用阿拉伯数字标明原子核中质子数目,在元素符号左上角用阿拉伯数字标明原子核中质子数和中子数之和。
(2) 电子式
在元素符号周围用小点表示原子最外层电子数目的式子。
写电子式时,阴离子要用[ ]号,并在其右角上表明所带电性和电量;阳离子除铵根离子外,一般就是其离子符号。电子式的书写包括:分子、原子、简单离子、某些复杂离子(如OH-、NH4+)、基(-CH3、-OH)、共价化合物、离子化合物及其形成过程。
|
原子电子式 |
阳离子 电子式 |
阴离子电子式 |
共价化合物 电子式 |
离子化合物 电子式 |
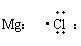 |
Na+ Mg2+ |
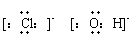 |
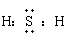 |
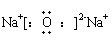 |
(3) 离子符号和化合价符号
离子符号是在元素是在元素符号的右上角用“+”、“-”表示其所带电性,在电性符号前边用阿拉伯数字标明所带电量, 1可以省略。如H+、S2-、SO42-离子。
化合价符号是在元素符号的上方用“+”、“-”表示正、负价,在“+”、“-”号后边用阿拉伯数字标明其价数。
|
|
镁离子 |
硫离子 |
氯化钙 |
氢氧化钠 |
|
离子符号 |
Mg2+ |
S2- |
Ca2+、Cl- |
Na+、OH- |
|
价标符号 |
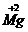 |
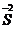 |
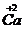 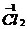 |
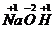 |
(4) 化学式、分子式、最简式、结构式和结构简式
①化学式:用元素符号表示物质组成的式子。从广义上讲分子式、实验式(最简式)、结构式和结构简式等都是化学式。
②分子式:用元素符号表示单质或化合物分子组成的式子。只有由分子构成的物质才有分子式。
注意:
I、分子式只适用于由分子组成的物质,离子晶体、原子晶体、金属晶体的组成微粒均不能用分子式来表示,因为它们不存在单个的分子;
II、分子式一般由实验测得,它既能表示一种物质,还能表示这种物质的一个分子及组成分子的原子种类或个数。
③最简式:通常又叫实验式。用元素符号表示化合物中元素的种类和各元素原子数或离子数的最简单整数比的式子。
④结构式:用价键表示分子里相接相连接的原子的结合情况的式子。
注意:
I、在结构工中用短线“-”来表示形成共价键的电子对,用“→”表示形成配位键的电子对;
II、通常所写的结构式能表示分子中各原子的结合方式和顺序,但不表示分子中各原子的空间排列;
III、由于同分异构现象的存在,用分子式不能区别的物质,则必须用结构式表示。
⑤结构简式:它是结构式的一种简单写法,但必须标出该分子的结构特征(如官能团)。如乙炔的结构简式为:CH≡CH,但不能写成CHCH。
结构式和结构简式只能表示分子中原子的连接顺序,而不能表示分子真实的空间结构。
|
名称 |
分子式 |
最简式 |
结构式 |
结构简式 |
|
乙炔 |
C2H2 |
CH |
H-C≡C-H |
CH≡CH |
|
乙酸 |
C2H4O2 |
CH2O |
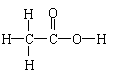 |
CH3COOH |
(5)化学式的命名
简单的命名格式是:阴电性名称+(化学介词)+阳电性组分名称,如:
|
类别 |
实例(名称) |
命名方法 |
物质组成 |
|
单质 |
Fe(铁)、C(碳)、Hg(汞)、Br(溴) |
固、液态叫某 |
同种元素的单原子、双原子或多原子 |
|
N2(氮气)、He(氦气)、D2(氘气)、O3(臭氧气) |
气态叫某气 |
||
|
氢化物 |
HCl(氯化氢)、NH3(氨气)、H2O(水) |
气态的叫某化氢 |
氢元素与另一非金属元素 |
|
NaH(氢化钠)、CaH2(氢化钙) |
固态的叫氢化某 |
氢元素与金属元素 |
|
|
氧化物 |
Fe2O3(氧化铁)、FeO(氧化亚铁) |
氧化某、氧化(亚)某 |
氧元素与另一非金属或金属元素 |
|
Na2O2(过氧化钠) |
过氧化某 |
||
|
碱 |
Fe(OH)3(氢氧化铁)、Fe(OH)2(氢氧化亚铁) |
氢氧(化、化亚)某 |
NH3·H2O |
|
NH3·H2O(氨水) |
|
||
|
酸 |
HBr(氢溴酸)、HCN(氢氰酸) |
氢某酸 |
氢离子与酸根离子(命名中的“某”是指酸中的成酸元素而言) |
|
H2SO4(硫酸) |
某酸(正) |
||
|
HClO4(高氯酸)、HClO2(亚氯酸)、HClO(次氯酸)、H3PO4(正磷酸)、HPO3(偏磷酸) |
(高、亚、次、正、偏、焦)某酸 |
||
|
H2S2O3(硫代硫酸) |
某代某酸 |
||
|
正盐 |
FeCl3(氯化铁)、FeCl2(氯化亚铁) |
某化某、某化亚某 |
金属(或铵)离子与酸根离子 |
|
CuSO4(硫酸铜)、Cu2SO4(硫酸亚铜) |
某酸某、某酸亚某 |
||
|
酸式盐 |
NaHCO3(碳酸氢钠、酸式碳酸钠) |
某酸氢某、酸式某酸某 |
金属(或铵)离子、氢离子与酸根离子 |
|
NaHS(硫氢化钠、酸式硫化钠) |
某氢化某、酸式某化某 |
||
|
碱式盐 |
Cu2(OH)2CO3(碱式碳酸铜) |
碱式某酸某 |
金属(或铵)离子、氢氧根离子与酸根离子 |
|
Cu(OH)Cl(碱式氯化铜) |
碱式某化某 |
||
|
复盐 |
KNaCO3(碳酸钠钾)、KAl(SO4)2(硫酸铝钾) |
某酸某某 |
两种金属(或铵)离子与一种酸根离子 |
|
水合物 |
CuSO4·5H2O(五水合硫酸铜) |
几水某酸某 |
盐与结晶水 |
6、例题
例1.已知常温、常压下,饱和碳酸溶液的pH=3.9,试推断用标准盐酸滴定未知浓度的NaHCO3溶液时,适宜选用的指示剂及滴定终点时指示剂颜色变化情况是
A.选石蕊作指示剂,颜色由蓝变红 B.选甲基橙作指示剂,颜色由橙变黄
C.选酚酞作指示剂,溶液的红色褪去 D.选甲基橙作指示剂,颜色由黄变橙
解析:选的指示剂的变色范围要尽可能接近恰好中和时的pH值。甲基橙的变色范围在3.1-4.4,与该滴定后溶液的pH值3.9接近,应选甲基橙作指示剂,因滴定时溶液的pH值由大到小,故指示剂甲基橙颜色由黄到橙色。
答案为D
例2.用某仪器测量一种溶液时,正确读数时为amL,仰视读数时为bmL,俯视读数时为cmL,若a>b>c,则所使用的仪器可能是
A.量筒 B.酸式滴定管 C.碱式滴定管 D.容量瓶
解析:量筒无“0”刻度,最大刻度在上方;滴定管“0”刻度在下方,最大刻度在下方。量溶液仰视时读数偏下方,对于量筒读数偏小,滴定管读数偏大;俯视时读数偏上方,对于量筒读数偏小,滴定管读数偏大;容量瓶不能用来测量溶液的体积,只有一个刻度。
答案为BC
例3.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250ml溶量瓶中配制250ml烧碱溶液;
B.用碱式滴定管(或移液瓶移取)量取25ml烧碱溶液于锥形瓶中并加几滴甲基橙指示剂;
C.在天平上准确称取烧碱样品wg,在烧瓶中加蒸馏水溶解;
D.将物质的量浓度为mmol/L的标准硫酸溶液装入酸式滴定管,调整液面,记下开始刻度数V1 ml
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点耗酸体积V2ml。
回答下列问题:
(1)正确的操作步骤顺序是(填写字母)____,_____,_____,D,_____。
(2)滴定管读数应注意________________________________________。
(3)操作中的锥形瓶下垫一张白纸的作用是______________________。
(4)操作D中液面应调整到_______________;尖嘴部分应__________________。
(5)滴定到终点时锥形瓶内溶液的pH约为__________;终点时溶液中指示剂的颜色变化是__________________。
(6)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响_________(填“偏高”“偏低”或“无影响”,其他操作均正确)
(7)该烧碱样品的纯度计算式是_____________________。
解析:该题先配置250mlNaOH溶液,取25ml烧碱溶液于锥形瓶中,用H2SO4进行滴定,以甲基橙做指示剂。滴定过程中需要注意的问题:滴定管应用所盛液体润洗,读数时视线应与凹液面最低点相平,尖嘴部分应充满液体等。
答案:(1)C,A,B,D,E。
(2) 滴定管应垂直;装液或放液后需等一会儿,待液面上下不发生变化时才能
读数;读数时目光不能俯视或仰视,视线应与液面最低点相平;读数应读到0.01ml。
(3)便于准确判断滴定终点时溶液的颜色变化情况。
(4)零刻度以下的某一刻度;充满溶液,无气泡。
(5)终点时,pH约为3.1-4.4;指示剂颜色由黄色变为橙色
(6)偏高。
(7)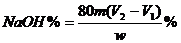
5、中和滴定结果的误差分析
消耗标准液多,结果偏高,消耗标准液少,结果偏低。
导致测定结果偏大的几种情况:
(1).盛标准液的滴定管水洗后未用标准液润洗.
(2).滴定前,盛标准液的滴定管尖嘴处有气泡就进行滴定,到终点后消失.
(3).锥形瓶用待测液进行润洗.
(4).滴定后,滴定管的尖嘴处悬有标准液液滴。
(5).滴定后,仰视滴定管读数。
(6).滴定前,俯视滴定管读数。
(7).滴定前俯视读数,滴定后仰视读数。
导致测定结果偏小的几种情况:
(1).盛待测液的滴定管水洗后未用待测液润洗即取待测液.
(2).滴定时,待测液溅出了锥形瓶.
(3).滴定后,俯视滴定管读数。
(4).滴定前,仰视滴定管读数。
(5).滴定前仰视读数,滴定后俯视读数。
4、中和滴定的操作步骤
(1)滴定前的准备:①洗涤 ②查漏 ③润洗 ④注液 ⑤排气泡 ⑥调整液面 ⑦读数
(2)滴定:①量取待测液并加指示剂 ②滴定至终点并读数 ③重复操作三次 ④计算
如:用KOH标准溶液滴定未知浓度盐酸,其操作可分为如下几步:
(1).用蒸馏水洗涤碱式滴定管,再用KOH标准溶液润洗2-3次.
(2).取KOH标准溶液注入碱式滴定管至”0”刻度以上2-3cm处.
(3).把盛有KOH标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液。
(4).调节碱式滴定管液面至”0”或”0”以下某刻度,记下读数V1。
(5).用酸式滴定管量取(或用移液管移取)20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞作指示剂。
(6).把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度V2.
(7).重复操作3次,求平均值。
注意:滴定时,左手控制滴定管的玻璃球(或活塞)将溶液逐滴滴入锥形瓶中,右手不断摇动锥形瓶。眼睛始终注视锥形瓶中指示剂颜色的突变,当指示剂颜色的突变半分钟内不褪色时停止滴加,并记录读数V2。
3、滴定管的使用方法
(1).滴定管是一种精确量具(0.01mL),滴定管有酸式和碱式之分,酸式滴定管用来盛酸性溶液(或KMnO4等氧化剂),碱式滴定管只能用来盛碱性溶液。
(2).滴定管使用时,先用自来水洗涤,然后用蒸馏水洗涤滴定管2-3次,再用待盛溶液润洗2-3次后,注入待盛溶液,注意驱赶滴定管尖嘴中的气泡。记录读数V1,读至小数点后第2位(0.01mL)。
(3).进行滴定操作时,左手控制滴定管将滴定管中溶液逐滴滴入锥形瓶中,右手顺时针方向不断地摇动锥形瓶使溶液混匀。滴加到锥形瓶中指示剂颜色发生突变时停止滴加,记录读数V2。
(4).滴加溶液的体积为V2-V1。为了使结果更可靠,应该重复进行三次滴定,最终取三次滴定结果的平均值。
2、中和滴定中的仪器及试剂
主要仪器有:酸式滴定管(不能盛放碱性溶液和HF)、碱式滴定管(不能盛放酸性溶液和KMnO4等氧化剂)、锥形瓶、铁架台、滴定管夹、烧杯、移液管等.
试剂有:标准溶液(已知浓度的某溶液)、待测溶液(要测浓度的某溶液),指示剂。
酸碱中和滴定用酚酞和甲基橙作指示剂,它们的变色范围:
酚酞:____(无色)_____8___(浅红)____10____(红色)_______;
甲基橙:___(红色)_____3.1___(橙色)_____4.4___(黄色)______.
氧化还原反应的滴定常用淀(与I2有关时);用KMnO4作氧化剂进行氧化还原滴定时,不要加指示剂,KMnO4本身就是指示剂.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com