
从结构上说,氨基酸是羰酸分子中烃基上的氢原子被氨基取代后衍变而成的物质。
1.结构特点:
(1)属于双官能团物质。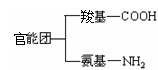 。
。
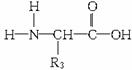
(2)α-氨基酸的结构通式为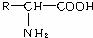 。
。
如果氨基酸分子中只含一个羧基和一个氨基而无别的不饱和键,那么它与含相同碳原子数的一硝基烷烃互为同分异构体。如,甘氨酸与硝基乙烷(分子组成均为C2H5NO2).
(2)化学性质:
(1)氨基酸分子中既有氨基(-NH2),又有羧基(-COOH)。-NH2可以结合H+形成-NH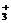 ,说明氨基酸具有碱性;-COOH可以电离出H+,形成-COO-,说明氨基酸具有酸性。故氨基酸具有两性--既能与强酸反应,又能与强碱反应:
,说明氨基酸具有碱性;-COOH可以电离出H+,形成-COO-,说明氨基酸具有酸性。故氨基酸具有两性--既能与强酸反应,又能与强碱反应:
|
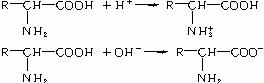
(2)氨基酸分子的氨基和羧基之间可以发生缩合脱水反应:
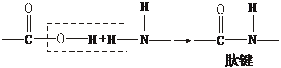
多个氨基酸分子间缩合脱水(缩聚)生成多肽,如:
|

→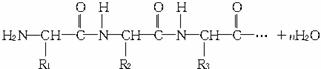
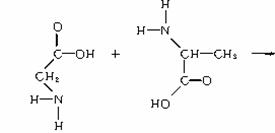
两个氨基酸分子之间脱去1分子水生成二肽,如:
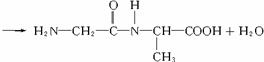
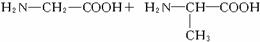
两个氨基酸分子间脱去2分子水生成环状化合物,如:
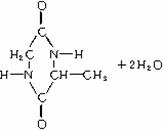
3.苯甲酸(又名安息香酸):
|
 或C6H5COOH
或C6H5COOH
例题解析
例1.将甲基、羟基、羧基和苯基四种原子团,两两结合形成的化合物中,其水溶液能使石蕊试液变红的有( ) A.2种 B.3种 C.4种 D.5种
|
 解析:题给四种基团两两组合的化合物中,显酸性的有CH3COOH、
解析:题给四种基团两两组合的化合物中,显酸性的有CH3COOH、
|
 、HO-COOH(即H2CO3)其中能使石蕊试液变红的有CH3COOH、
、HO-COOH(即H2CO3)其中能使石蕊试液变红的有CH3COOH、

|

|
故本题答案为B
例2.一定质量的某有机物与足量钠反应,可生成气体V1L;等质量的该有机物与足量的NaHCO3溶液反应,可得到气体V2L。同温同压下V1=V2。则该有机物的结构简式可能是( )
A.HO(CH2)3COOH D.HOCH2CH2CHO C.HOOC-COOH D.CH3COOH
解析:-OH、-COOH都能与金属钠反应生成H2,1mol-OH或1mol-COOH与钠反应可产生0.5molH2 ;-COOH与NaCO3反应生成CO2,1mol-COOH与NaCO3反应生成0.5molCO2。题设有机物与金属钠反应产生的气体的体积多于与纯碱反应产生的气体的体积,则有机物结构中既有-COOH又有-OH故本题答案为A
例3.已知葡萄糖在乳酸菌作用下可转化为乳酸(C3H6O3)。
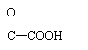
 (1)以9g乳酸与足量金属钠反应,可生成2.24LH2(标况),另取同量乳酸与同物质的量的乙醇反应,生成0.1mol乳酸乙酯和1.8g水,由此可推断乳酸分子中含有的官能团名称为 。
(1)以9g乳酸与足量金属钠反应,可生成2.24LH2(标况),另取同量乳酸与同物质的量的乙醇反应,生成0.1mol乳酸乙酯和1.8g水,由此可推断乳酸分子中含有的官能团名称为 。
(2)乳酸在铜作催化剂时可被氧化成丙酮酸(CH3- )由以上事实推知乳酸的结构简式为 。
(3)两个乳酸分子在一定条件下脱水生成环酯(C6H8O4),则此环酯的结构简式
。
(4)在一定条件下,乳酸发生缩聚反应生成聚酯,该高聚物可表示为
解析:根据乳酸分子式,求出其相对分子质量为90。9g乳酸为0.1mol,0.1mol乳酸与0.1mol乙醇反应生成0.1mol乳酸乙酯,可知1mol乳酸中含有1mol-COOH,又知0.1mol乳酸与足量金属钠反应生成0.1molH2,可得1mol乳酸分子中还含有1mol醇羟基。根据乳酸在铜催化条件下氧化成CH3 COOH,可知醇羟基位置在碳链中间。据此可推导出原来乳酸的结构简式为CH3-CH-COOH
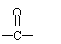 OH
OH
答案:(1)羧基、醇羟基 (2)CH3-CH-COOH (3)
|
OH
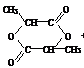
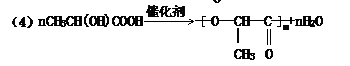
2.常见高级脂肪酸:
 硬脂酸:C17H35COOH(固态)
硬脂酸:C17H35COOH(固态)
 饱和
饱和
软脂酸:C15H31COOH(固态)
不饱和:油酸:C17H33COOH(液态)
由烃基和羧基直接相连的化合物叫做羧酸。一元饱和脂肪酸的通式为:CnH2n+1COOH, 分子式通式为:CnH2nO2 。
1.甲酸:甲酸既有羧酸又有醛基,所以能表现出羧酸和醛的性质。
⑴ 具有-COOH的性质:
HCOOH + CH3OH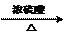 HCOOCH3 + H2O
HCOOCH3 + H2O
HCOOH + NaOH HCOONa + H2O
HCOONa + H2O
⑵ 具有-CHO的性质。如:甲酸能与新制Cu(OH)2反应。
HCOOH+2 Cu(OH)2 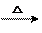 Cu2O↓+3H2O+CO2↑
Cu2O↓+3H2O+CO2↑
1.乙酸的结构、性质和制法
|
(2)化学性质
① 弱酸性(断O-H键):
CH3COOH
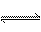 CH3COO- + H+(酸性比碳酸强)
CH3COO- + H+(酸性比碳酸强)
CaCO3 + 2CH3COOH  (CH3COO)2Ca +
CO2↑ + H2O
(CH3COO)2Ca +
CO2↑ + H2O
Cu(OH)2 + 2CH3COOH  (CH3COO)2Cu +
2H2O
(CH3COO)2Cu +
2H2O
② 酯化反应(断C-O键)
|
|
 CH3COOC 2H5 + H2O
CH3COOC 2H5 + H2O
注意:
① 浓硫酸的作用:催化剂和吸水剂。
② 盛反应液的试管要向上倾斜45°,这样液体受热面积大。
③ 导管末端不能插入饱和Na2CO3溶液中,目的是防止受热不匀发生倒吸。
④ 不能用NaOH代替Na2CO3,因为NaOH溶液碱性很强,会使乙酸乙酯水解。
⑤ 实验中小火加热保持微沸,这样有利于产物的生成和蒸发。
⑥ 饱和Na2CO3溶液的作用是:冷凝酯蒸气;减小酯在水中溶解度(利于分层);中和乙酸;溶解乙醇。
⑦ 酯化反应中可用18O作示踪原子,证明在酯化反应中由酸分子上的羟基与醇羟基上的氢原子结合而生成水,其余部分结合成酯。
⑧ 酯化反应是一个可逆反应。
(3)工业制法:
①发酵法:淀粉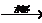 C6H12O6
C6H12O6 C2H5OH
C2H5OH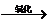 H3CHO
H3CHO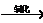 CH3COOH。
CH3COOH。
②乙烯氧化法:
2CH2=CH2+O2 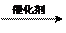 2CH3CHO 2CH3CHO+O2
2CH3CHO 2CH3CHO+O2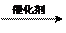 2CH3COOH
2CH3COOH
在有机化学中,除了用化合价升降来分析氧化还原反应外,还可以用得失氢(氧)原子来分析:“加氧去氢是氧化,加氢去氧是还原”。
例题解析
例1、某学生做乙醛还原性的实验,取1 mol·L-1的硫酸铜溶液2 mL和0.4 mol·L-1的氢氧化钠溶液4 mL,在一个试管内混合加入0.5 mL 40%乙醛溶液加热至沸,无红色沉淀。实验失败的原因是
A.氢氧化钠不够量 B.硫酸铜不够量
C.乙醛溶液太少 D.加热时间不够
解析: 据题中所给的CuSO4和NaOH的物质的量比较,NaOH完全反应,CuSO4过量,溶液不显碱性,所以实验失败。
答案: A。
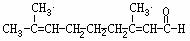 例2、已知柠檬醛的结构简式如下:
例2、已知柠檬醛的结构简式如下:
(1)检验柠檬醛中的醛基的方法是 。
(2)检验柠檬醛中的C=C的方法是 。
(3)实验操作中哪一个官能团应先检验?
解析:(1)加入银氨溶液后,水浴加热有银镜生成,可证明醛基存在;
(2)在加银氨溶液氧化-CHO后,调PH至中性再加入溴水,看是否褪色;
(3)由于Br2也以能氧化-CHO,所以必须先用银氨溶液氧化-CHO,又因为氧化后溶液为碱性,可能还有过量的银氨溶液,它也能使溴水褪色且形成淡黄色浑浊,不利于现象的观察,所以应先酸化后再加溴水检验双键。
答案: 见解析。
例3、某3g醛和足量的银氨溶液反应,结果析出43.2gAg,。则该醛为
A.甲醛 B.乙醛 C.丙醛 D.丁醛可以还原得2mol银,现得到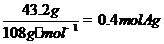 ,故醛为0.2mol,该醛的摩尔质量为
,故醛为0.2mol,该醛的摩尔质量为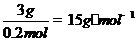 ,没有摩尔质量为15g·mol-1醛,该题似乎无解,但1mol甲醛可以得到4molAg,再试
,没有摩尔质量为15g·mol-1醛,该题似乎无解,但1mol甲醛可以得到4molAg,再试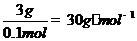 ,存在即是甲醛。
,存在即是甲醛。
|

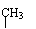
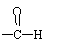
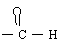
 OH
OH
|
|
|
|
|

羟醛受热很容易脱水生成不饱和醛,试写出以乙炔为原料(无机试剂可以任选),合成正丁醇的化学方程式。
解析:正丁醇有4个碳,而乙炔只有2个碳,分析所给信息,2分子乙醛反应可得4个碳的羟醛,而乙醛可由乙炔制得。羟醛中的醛基可加氢得到羟基,羟醛中的羟基脱水可生成碳碳双键,再与H2加成即可得正丁醇。
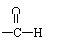
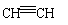 答案:①
+ H2O
答案:①
+ H2O 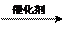 CH3CHO
CH3CHO
 ②2CH3CHO
②2CH3CHO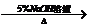 CH3CHCH2
CH3CHCH2
OH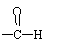
 ③CH3CHCH2
③CH3CHCH2
 CH3CH=CHCHO
CH3CH=CHCHO
OH
2.醛与氢氧化铜的反应:
(1)硫酸铜与碱反应时,碱过量制取氢氧化铜
(2)将混合液加热到沸腾才有明显的砖红色沉淀
(3)量的关系:1mol-CHO可生成1molCu2O
1.银镜反应
(1)配制银氨溶液时,应防止加入过量的氨水,并且必须随配随用,不可久置,否则会生成易爆物质。这类物质哪怕用玻璃刮擦也会分解而发生猛烈爆炸。
(2)如果试管不洁净,加热时振荡或加入醛的量不恰当,均可能生成黑色疏松的银的沉淀。
(3)试管内壁附着的银镜,可先用稀HNO3溶解,然后再用水清洗。
(4)反应的量的关系:1mol-CHO可生成2molAg
3. 酮类
饱和一元酮的通式CnH2nO(n≥3),酮类没有还原性,不与银氨溶液、新制Cu(OH)2浊液反应,故此可用于鉴别醛和酮。
2.醛类
饱和一元醛的通式CnH2nO(n≥1);化学通性主要为强还原性,可与弱氧化剂如银氨溶液、新制Cu(OH)2浊液反应,生成羧酸,其氧化性一般仅限于与氢加成而生成醇。醛基比较活泼,也能发生加聚和缩聚反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com