
3.高分子化合物的分类
(1)按照高分子化合物的来源分类,可分为天然高分子化合物和合成高分子化合物。天然有机高分子化合物有淀粉、纤维素、蛋白质、天然橡胶。
(2)按照高分子化合物分子链分类,可分为线型高分子、支链型高分子和体型高分子。
(3)按照高分子化合物受热时的不同行为分类,可分为热塑性高分子和热固性高分子。
(4)按照高分子化合物的工艺性质和使用分类,可分为塑料、橡胶、纤维、涂料、黏合剂和密封材料。
2.有机高分子化合物与低分子有机物的区别
(1)它们最大的不同是相对分子质量的大小。有机高分子化合物的相对分子质量一般高达104-106,而低分子有机物的相对分子质量在1000以下。
(2)低分子有机物的相对分子质量都有一个明确的数值,而高分子化合物的相对分子质量只是一个平均值。它是以低分子有机物作原料,经聚合反应得到各种相对分子质量不等的组成结构类似的混合物,没有固定的熔沸点。
(3)合成有机高分子的基本结构与低分子有机物的单一结构不同,它是由若干个重复结构单元组成的高分子。因此,由重复结构单元可以知道低分子有机物原料的组成与结构。
(4)由于高分子化合物与低分子有机物在相对分子质量和结构上的差异,它们在物理、化学性质上也有较大差别。
1.几个概念
(1)高分子化合物:有许多小分子化合物以共价键结合成的、相对分子质量很高(通常为104-106)的一类化合物。也称聚合物或高聚物。
(2)单体:用来合成高分子化合物的小分子化合物。
(3)链节:组成高分子链的化学组成和结构均可以重复的最小单位。也可称为最小结构单元,是高分子长链中的一个环节。
(4)链节数:高分子链节的数目,也称重复结构单元数。以n表示。
(1)质量守恒定律
参加反应的各种物质的质量总和等于反应后生成的各物质的质量总和。这一定律是书写化学方程式和化学计算的依据。
例5:m molC2H2跟n molH2在密闭容器中反应,当其达到平衡时,生成p mol C2H4。将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质量是
A、3m+n B、5/2m+n/2-p/3 C、3m+n+2p D、5m/2+n/2
解析:本题如果按传统的方法也能得出正确结果,但费时多,而利用质量守恒定律解题快而简洁。C~CO2~O2, 4H~2H2O~O2
因此,m molC2~2m molO2 (2m+2n)molH ~(2m+2n)/4 mol O2
总氧气量:2m+(2m+2n)/4=5m/2+n/2 答案为D。
(2)阿佛加德罗定律
在相同温度和压强下,同体积的任何气体都含有相同数目的分子。
阿佛加德罗定律的应用:
①标准状况下气体的体积(L)=22.4mol/L×物质的量(mol)
气体摩尔质量(g/mol)=22.4mol/L×标准状况下气体的密度(g/L)
②同温同压下任何气体的体积比等于其分子个数之比,也等于其物质的量之比
③同温同压下任何气体的密度比等于其相对分子质量之比,也等于同体积的质量之比。
④在温度和体积一定时,气体的压强与物质的量成正比;若温度和压强一定时,气体的体积与物质的量成正比。
⑤在温度与气体的物质的量一定时,其气体的压强与体积成反比。
例6:A容器中盛有体积百分比为80%的H2和20%的O2,试求:
(1)混合气体中H2和O2的分子数之比、质量之比各为多少?
(2)混合气体的平均分子量是多少?它在标准状况下的密度是多少?
(3)在1500C时,引燃混合气体,反应结束后恢复到1500C,则反应后混合气体的平均分子量是多少?引燃前后,,A容器内的压强有什么变化?密度是否变化?
解析:(1)分子数之比等于体积比等于物质的量比,所以
H2和O2的分子数之比为:80%:20%=4:1
质量之比为:4×2:1×32=1:4
(2)混合气体的平均分子量M=2×80%+32×20%=8
在标准状态下r=8/22.4=0.357(g/L)
(3) 2H2 + O2 = 2 H2O
2mol 1mol 2mol
可见,4molH2和1molO2反应后,得到了2mol H2O和2molH2的混合气体,所以
反应后的平均分子量为:18×2/4+2×2/4=10;
在保持温度和体积不变的条件下,气体的压强之比等于物质的量之比
所以 P前:P后=(4+1):(2+2)=5:4。
反应后压强变小,根据质量守恒定律,反应前后的质量不变。
A容器的体积不变,所以混合气体的密度不变。
(深圳大学附中 陆秀臣)
3、气体摩尔体积:在相同的温度和压强下,1摩尔任何气体所占有的体积在数值上近似相等。人们将一定的温度和强下,单位物质的量的气体所占的体积叫做气体摩尔体积,它的常用单位是:L/mol。
1摩尔任何气体在标准状况下(00C,1.01×105Pa)所占的体积约是22.4L,这个体积叫做标准状况下气体的摩尔体积。记作Vm,其数值为22.4mol/L。
这个概念要同时具备3个要点:①在标准状况下,②1摩尔任何气体,③体积约是22.4L。
例2:下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1molNe含有的原子数为NA
C.71gCl2所含原子数为2NA
D.在同温同压下,相同体积的任何气体单质所含的原子数相同
答案:B、C
例3:同温同压下,某容器真空时的质量为201克,当它盛满甲烷时的质量为203·4克,而盛满气体Y时质量为205·5克,则Y气体的式量为多少?
解析:本题是考查的内容是气体的特征:即同温同压下,同体积的气体有相同的分子数
(203·4-201)/16=(203·4-201)/M
M=32
知识延伸:混合气体平均分子量:
M=M1×n1%+M2×n2%+M3×n3%
M1、M2、M3、 是每一种气体的相对分子质量;n1% 、n2% 、n3%是混合气体中每一种气体的物质的量分数。
例4:某固体A在一定的温度下分解生成气体B、C、D:2A=B+2C+3D,若测得生成气体的质量是相同体积的H2质量的15倍,则:
(1)生成的混合气体的摩尔质量为多少?
(2)固体A的摩尔质量是多少?
解析:混合气体的平均分子量:M=2×15=30
根据质量守恒定律:2MA=MB+2MC+3MD
而混合气体的平均分子量:M=(MB+2MC+3MD)×1/6=2MA×1/6=30
所以:MA=90
各物理量的相互关系
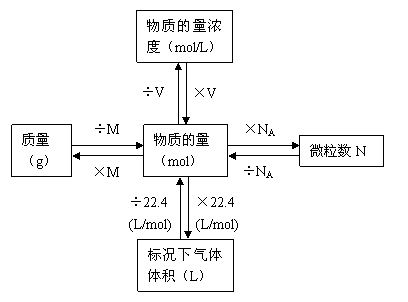
2、摩尔质量:人们将单位物质的量的物质所具有的质量叫做摩尔质量,它的常用单位为g/mol。物质的量(n)、物质的质量(m)和物质的摩尔质量(M)之间存在着以下关系:
n=m/M
1、物质的量、摩尔:物质的量是国际单位制的七种基本量之一,摩尔是物质的量的单位。每摩尔物质含有阿佛加德罗常数个微粒,阿伏加德罗常数:其数值为0.012 kg 12C 所含的碳原子数,大约为6.02×1023,单位:mol-1
其中微粒指微观粒子如:分子、原子、离子、质子、电子或其它粒子或它们的特定组合。
例1:下列关于物质的量的说法中不正确的是
A.物质的量是国际单位制的7个基本单位之一
B.物质的量实际上表示含有一定数目的粒子集体
C.物质的量的单位是“摩尔”
D.是表示物质数量的单位
解析:不正确的说法是D。
0.2molA与0.4molO2反应,生成0.2molCO2、0.2molCO和0.6molH2O。即1molA与2molO2反应,生成1molCO2、1molCO和3molH2O。根据质量守恒定律得A的分子式为C2H6O2,其相对分子质量为62。
与0.2molA反应的n(Na)=9.2g/23 g•mol-1=0.4mol,即1molA可以与2molNa反应,说明1个A分子中含有两个羟基,所以A的结构简式为HOCH2-CH2OH,乙二醇。
例2 已知柠檬醛的结构简式为:(CH3)2C=CHCH2CH2C(CH3)=CHCHO
(1)检验柠檬醛分子中含有醛基的方法是 ____ ;
(2)检验柠檬醛分子中含有碳碳双键的方法是 。
[解答](1)加入银氨溶液后加热,有银镜出现或加入新制的氢氧化铜悬浊液加热至沸有红色沉淀生成。
(2)先加入银氨溶液氧化醛基后,再加入溴水使其褪色。(注意:不可直接用溴水检验)
例3 香豆素是一种香料,常用于皂用香精及其他日用化工。香豆素的分子式是C9H6O2,分子中除有一个苯环外,还有一个六元环。已知有机物A(C7H6O2) 和乙酸酐
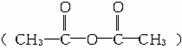
在一定条件下经下面一系列的反应,可制得香豆素:
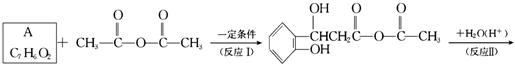

(1)试确定有机物A、B、C和香豆素的结构简式
A_______________;B_______________;C_______________;香豆素_______________。
(2)判断反应Ⅰ、Ⅱ的反应类型:Ⅰ._____________,Ⅱ._____________。
解析:此题为有机推断题。它通过一系列的合成路线,以反应Ⅰ的产物
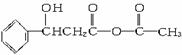
为突破点,进而推出A、B、C的结构。


0.2mol 3.2g
还原氧化铜的CO的物质的量n(CO)=生成的CO2的物质的量n(CO2)=0.2mol
被碱石灰吸收的n(CO2)=17.6g/44 g•mol-1=0.4mol ,其中由A燃烧生成的n(CO2)=0.4mol-0.2mol=0.2mol
7.盐析:向油脂碱性水解后的产物中,加入食盐细粒,可使高级脂肪酸钠的溶解性减小而析出。盐析是个可逆过程。
常见的除杂方法
|
物质(杂质) |
试 剂 |
方 法 |
|
苯(苯酚) |
NaOH溶液 |
分液 |
|
乙酸乙酯(乙酸) |
饱和Na2CO3溶液 |
分液 |
|
溴苯(Br2) |
NaOH溶液 |
分液 |
|
乙醇(少量水) |
新制生石灰 |
蒸馏 |
|
乙醇(乙酸) |
CaO或NaOH |
蒸馏 |
|
淀粉(NaCl)溶液 |
蒸馏水 |
渗析 |
|
水(溴) |
苯或四氯化碳 |
分液 |
|
甲烷(乙烯) |
溴水 |
洗气 |
物质分离和提纯时,还可以应用的化学方法有①热分解法 ②氧化还原法 ③沉淀法
④酸碱溶法 ⑤水解法等。
化学法提纯和分离物质应遵守“四原则”和“三必须”。“四原则”是一不增(不增加新物质),二不减(不减少被提纯物质)、三易分离(被提纯物与杂质易分离)、四易复原(被提纯物易复原)。“三必须”是除杂试剂必须过量,过量的试剂必须除尽,除杂途径必须最佳。
例1 0.2mol有机物A和0.4molO2在密闭容器中燃烧后的产物为CO2、CO、H2O(g),产物经过浓硫酸,质量增加10.8g;再通过灼热的CuO,充分反应后,质量减轻3.2g;最后气体再通过碱石灰被完全吸收,质量增加17.6g。试推断该有机物A的分子式和相对分子质量。若0.2mol的A恰好与9.2g金属钠完全反应,试确定该有机物的结构简式并命名。
[解析] 由题意知,被浓硫酸吸收的水蒸气的物质的量
n(H2O)=10.8g/18g•mol-1=0.6mol
求与CuO反应的CO的物质的量 CO+CuO=Cu+CO2 减轻Δm
1mol 16g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com