
3.差量法
找出化学反应前后某种差量和造成这种差量的实质及其关系,列出比例式求解的方法,即为差量法。其差量可以是质量差、气体体积差、压强差等。
[例题7]加热碳酸镁和氧化镁的混合物mg,使之完全反应,得剩余物ng,则原混合物中氧化镁的质量分数为( )
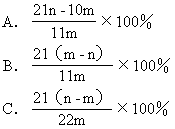
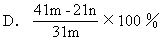
[解析]设MgCO3的质量为x
MgCO3M M gO+CO2↑混合物质量减少
M gO+CO2↑混合物质量减少


应选A。
2.守恒法
化学方程式既然能够表示出反应物与生成物之间物质的量、质量、气体体积之间的数量关系,那么就必然能反映出化学反应前后原子个数、电荷数、得失电子数、总质量等都是守恒的。巧用守恒规律,常能简化解题步骤、准确快速将题解出,收到事半功倍的效果。
[例题5]FeS2与硝酸反应产物有Fe3+和H2SO4,若反应中FeS2和HNO3物质的量之比是1∶8时,则HNO3的还原产物的化学式为_________。
[解析]设反应中FeS2和HNO3物质的量分别是1mol和8mol,则未被还原(生成硝酸铁)的硝酸为3mol,被还原的硝酸为5mol。又设HNO3的还原产物中N元素的化合价为x,根据电子转移守恒可得:5·(+5-x)=1·[+3-(+2)]+2·[6-(-1)]解得x=+2,则还原产物为NO。
[例题6]酸雨是因为过度燃烧煤和石油,生成的硫的氧化物与氮的氧化物溶于水生成硫酸和硝酸的缘故。某次雨水的分析数据如下:c(NH4+)=2.0×10-6mol/L、c(Cl-)=6.0×10-6mol/L
c(Na+)=3.0×10-6mol/L、c(NO3-)=2.3×10-5mol/L、c(SO42-)=2.8×10-5mol/L。则此次雨水的pH大约为 ( )
A.3 B.4 C.5 D.6
[解析]根据电荷守恒(由于溶液呈酸性,故计算中可以略去氢氧根离子)
c(H+)+c(NH4+)+c(Na+)= c(Cl-)+c(NO3-)+2c(SO42-),
c(H+)= c(Cl-)+c(NO3-)+2c(SO42-)-c(NH4+)-c(Na+)
=6.0×10-6mol/L+2.3×10-5mol/L +2×2.8×10-5mol/L -2.0×10-6mol/L -3.0×10-6mol/L
=8.0×10-5mol/L
pH=-lg[H+]=5-lg8≈4
正确答案为B。
1.关系式法:
关系式法是根据化学方程式计算的巧用,其解题的核心思想是化学反应中质量守恒,各反应物与生成物之间存在着最基本的比例(数量)关系。
[例题4]某种H2和CO的混合气体,其密度为相同条件下氧气密度的1/2,将3.2g这种混合气体在足量的O2中充分燃烧后通入一盛有足量Na2O2的密闭容器中,最后容器中固体质量增加了 ( )
A.3.2 g B.4.4 g C.5.6 g D.6.4 g
[解析]此题应根据化学方程式中体现的计量关系用以下关系式巧解:
 固体增加的质量即为H2的质量。
固体增加的质量即为H2的质量。
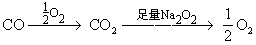 固体增加的质量即为CO的质量。所以,最后容器中国体质量增加了3.2g,应选A。
固体增加的质量即为CO的质量。所以,最后容器中国体质量增加了3.2g,应选A。
解题关键是找出反应中量的关系。
0.1mol硫酸消耗0.02molOH-,所以,盐酸消耗0.02molOH-,nHCl=0.02mol
原混合液中CH2SO4=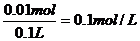 CHCl=
CHCl=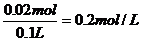
7.利用化学方程式的计算
[例题1]今测得某硝酸铵化肥中含氮量为38.5%,则该化肥中可能混有( )
A.NH4HCO3 B.(NH4)2SO4 C.NH4Cl D.CO(NH2)2
[解析]NH4NO3中氮元素的质量分数=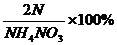 =
=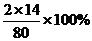 =35%,按照同样的方法计算各物质中氮元素的质量分数,只有尿素中氮元素的质量分数高于35%,所以选D。
=35%,按照同样的方法计算各物质中氮元素的质量分数,只有尿素中氮元素的质量分数高于35%,所以选D。
答案:D。
[例题2]N、O两种元素形成的化合物中N、O两种元素的质量比为7 :12,试写出其化学式。
[解析]设其化学式为NxOy,则:mN :mO=14x :16y=7 :12
所以,x :y=2 :3 化合物的化学式为:N2O3
[例题3]稀硫酸和稀盐酸的混合液100mL加入0.3mol/L的氢氧化钡溶液100mL,充分反应后,经过滤得沉淀2.33g,又测得所得滤液中OH-浓度为0.1mol/L。则原混合液中稀硫酸和稀盐酸的物质的量浓度分别为___________、_____________(设不考虑溶液体积的变化)。
[解析]设硫酸的物质的量为x
H2SO4+Ba(OH)2=BaSO4↓+2H2O
1mol 233g
X
2.33g
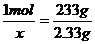 x=0.01mol
x=0.01mol
滤液中nOH-=0.1mol/L×0.2L=0.02mol
∴反应消耗的nOH-=0.3mol/L×2×0.1L-0.02mol=0.04mol
6.有关溶液pH与氢离子浓度、氢氧根离子浓度的简单计算
5.有关溶液质量分数、物质的量浓度的计算
4.有关混合物质量分数、体积分数的计算
3.有关气体摩尔体积的计算
2.有关物质的量的计算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com