
2.有关离子浓度的计算,注意利用电荷守恒原理
例3:硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4 mol·L-1,硫酸根离子浓度为0.7 mol·L-1,则K+的物质的量浓度为( )
A.0.1 mol·L-1 B.0.15 mol·L-1 C.0.3 mol·L-1 D.0.2 mol·L-1
解析:正确答案选D。假设烧瓶的容积为1L,则根据电荷守恒3nAl3++ nK+=2 nSO42-,得
K+的物质的量浓度为0.2 mol·L-1。
1.有关概念的计算:利用“万能恒等式”
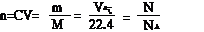
例2:在标准状况下,用充满HCl气体的烧瓶做喷泉实验,最终水充满烧瓶,则盐酸的物质的量浓度为( )
A.0.05 mol·L-1 B.0.01 mol·L-1 C.0.045 mol·L-1 D.无法计算
解析:正确答案选C。假设烧瓶的容积为V升,则HCl气体的体积为V升,最后所得盐酸溶液的体积也为V升,所以: cHCl=
cHCl=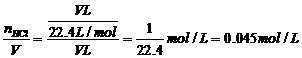
2.配制步骤
(1)计算:根据配制要求计算出所需固体溶质的质量或所需浓溶液的体积
(2)称量:用托盘天平称量固体溶质的质量或用量筒量取溶质的体积
(3)溶解:将称量或量取的溶质放入烧杯中再加入适量的蒸馏水,用玻璃棒搅拌使之溶解。
(4)转移:将溶解的溶液冷却至室温,沿玻璃棒注入准备好的容量瓶里,并用适量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,并将洗涤液转移至容量瓶中。
(5)定容:往容量瓶中继续缓慢地加入蒸馏水至距刻度1-2cm处,改用胶头滴管逐滴加入蒸馏水直到凹液面最低点与刻度线水平相切,盖好容量瓶塞,颠倒摇匀,然后将配好的溶液装入干净试剂瓶中,贴上标签,注明名称、浓度、配制日期。
原理:cB = nB/V=m/MV(M-溶质的摩尔质量,配制某种溶液时是定值)
(1)称量或量取时所引起的误差
使所配溶液的物质的量浓度偏高的主要原因:
①天平的砝码沾有其他物质或已锈蚀,导致称量物质的实际值是大于称量值;
②称量时游码忘记归零;
③调整天平零点时,游码放在了刻度线的右端;
④用滴定管量取液体时,开始时平视读数,结束时俯视读数,使所量取的液体的体积偏大,等等。
使所配溶液的物质的量浓度偏低的主要原因:
①直接称热的物质,含有水份,称的重,实际质量却小;
②砝码有残缺;
③在敞口容器中称量易吸收空气中其他成分或易于挥发的物质时的动作过慢而变质;
④用滴定管量取液体时,开始时平视读数,结束时仰视读数,使所量取的液体的体积偏小,等等。
(2)用于溶解稀释溶液的烧杯未用蒸馏水洗涤,使溶质的物质的量减少,致使溶液的浓度偏低。
(3)转移或搅拌溶液时有部分液体溅出,致使溶液浓度偏低。
(4)容量瓶内溶液的温度高于20℃,造成所量取的溶液的体积小于容量瓶上所标注的液体的体积,致使溶液浓度偏高。
(5)在给容量瓶定容时,仰视读数会使溶液的体积增大,致使溶液浓度偏低;俯视读数会使溶液的体积减小,致使溶液浓度偏高。
例1:利用硫酸铜晶体(CuSO4·5H2O)配制0.2 mol/L的CuSO4溶液500mL,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏低的是( )
A.定容时,俯视观察刻度线
B.称取25g的硫酸铜晶体
C.定容后摇匀,静置时发现液面低于刻度线,于是又加水至刻度线
D.移液时,不小心将一滴液体溅出容量瓶。
解析:正确答案选CD。A项中俯视时液面的最低点低于刻度线,使得溶液的体积偏低,导致浓度偏高;B项是正确操作,不会影响浓度;C项摇匀后低于刻度线是由于液体沾在瓶壁和磨口处所致,不会引起误差,若加水则使浓度偏低;D项由于溅出液体,使得溶质的物质的量偏小,导致浓度偏低。
1. 所需实验仪器
托盘天平、钥匙、烧杯、玻璃棒、容量瓶、胶头滴管,若溶质为液体或浓溶液,上述仪器中的托盘天平、钥匙改为量筒。
4.在一定浓度的溶液里取出任意体积的溶液,其浓度大小不变,所含溶质的质量改变。
3.V是溶液体积,不是溶剂体积。
2.带有结晶水的物质作为“溶质”时,溶质是不含结晶水的化合物;NH3、Cl2等溶于水后成分复杂,求算浓度时仍以溶解前的NH3、Cl2为溶质。
以单位体积溶液中所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
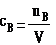
表达式:
单位:mol·L-1或mol·m -3
注意:
1.溶质可以是单质、化合物,如C(Cl2)=0.1mol·L-1,C(NaCl)=3.1mol·L-1;也可以是离子或其他特定组合,如C(Al3+)=2.6mol·L-1,C(SO42-)=0.3mol·L-1。
[例5] 传统饮用水的消毒剂是氯气。本世纪80年代初期科研人员在英国某城调查发现,儿童患白血病发病率高是源于饮了氯气消毒的饮用水,这是因为
A.氯气有氧化性,作用于正常细胞而癌化
B.氯水中的次氯酸具有杀菌性,氧化了正常细胞,异化为癌细胞
C.氯气有毒,杀死正常细胞,不杀灭癌细胞
D.氯气作用于水中有机物,生成有机氯化合物而致癌
答案:D
食品添加剂是指为改变食物品质和色、香、味,以及根据防腐和加工的需要而加入的化学合成品或天然物质。常见食品添加剂有营养强化剂、防腐剂、抗氧化剂、着色剂、膨松剂、甜味剂、发色剂。
[例1] 含有食品添加剂的食品一定不安全吗?凡是天然的、未使用食品添加剂的食物都能安全食用吗?试举例说明。
答案:不一定。化学合成的物质不一定有毒,天然物质不一定无毒。例如:豆类食物属于天然物质,它们所含的植物凝集素和胰蛋白酶抑制剂等对人体就有害。事实证明,具有相同的化学结构和质量指标的化学合成物质与天然物质的提取物没有什么区别。
由于食品当中营养成分比较丰富,所以特别容易在环境条件适合的时候引起微生物的繁
殖,致使食品腐化变质,吃了往往会引起食物中毒。在食品中加入极微量的防腐剂用来抑制微生物的滋长,不仅对防止某些易腐食品的损失有显著的效果,还可杀灭黄曲霉素等产毒微生物,这无疑是有益于人体健康的。
应遵循《食品添加剂使用卫生标》。在规定范围内使用食品添加剂,一般对人体健康无害。如果违反规定,超量使用食品添加剂将会损害人体健康!食盐也是一种食品添加剂,如果一次性大剂量的食用食盐的话,就有可能造成人的急性致死,你能说食盐对人体有危害吗?有句话叫做“剂量决定危害”。
[例2] 在食品加工或餐饮业中使用量特别要注意严加控制的物质是 ( )
A. 氯化钠 B. 谷氨酸钠(味精) C. 碳酸氢钠 D. 亚硝酸钠
答案:D
[例3] 随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是( )
A、无水硫酸铜、蔗糖 B、硅胶、硫酸亚铁
C、食盐、硫酸亚铁 D、生石灰、食盐
答案:B
[例4] 最近新闻媒体报道了数起因食用有“瘦肉精”的猪肉和内脏,而发生群体急性中毒的恶性事故。这足以说明目前由于奸商的违法经营已使“瘦肉精”变成了“害人精”。“瘦肉精”的结构可表示为:
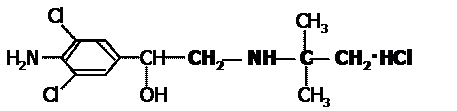
(1)其化学式为 ;
(2)它不可能发生的反应为 ;
A、水解反应 B、加成反应 C、与钠反应放出氢气 D、加聚反应
(3)从结构上分析,该物质可看 类物质
A、芳香族化合物 B、醇 C、卤代烃 D、氨基酸
答案:(1)C12H19Cl3N2O (2)A、B (3)D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com