
4.胶体的制备
(1)物理法:
如研磨(制豆浆、研墨),直接分散(制蛋白胶体)
(2)水解法:
[Fe(OH)3胶体]向20mL沸蒸馏水中滴加1mL-2mLFeCl3饱和溶液,继续煮沸一会儿,得红褐色的Fe(OH)3胶体。离子方程式为:
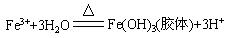
(3)复分解法:
(AgI胶体)向盛10mL 0.01mol·L-1 KI的试管中,滴加8-10滴0.01mol·L-1 AgNO3,边滴边振荡,得浅黄色AgI胶体。
(硅酸胶体)在一大试管里装入5mL-10mL1mol·L-1HCl,加入1mL水玻璃,然后用力振荡即得。
离子方程式分别为:Ag++I-=AgI(胶体)
SiO32-+2H++2H2O=H4SiO4(胶体)
复分解法配制胶体时溶液的浓度不宜过大,以免生成沉淀。
3.胶体的性质和应用
(1)丁达尔现象
①定义:光束通过胶体时,形成光亮的通路的现象。
②解释:胶体分散质的粒子比溶液中溶质的微粒大,使光波发生散射。
③应用:区别溶液和胶体。
(2)布朗运动
①定义:在超显微镜下可观察到胶体粒子在做不停的、无秩序的运动。
②水分子从个方向撞击胶体粒子,而每一瞬间胶体粒子在不同方向受的力是不同的。
(3)电泳现象
①定义:在外加电场的作用下,胶体粒子在分散剂里向电极作定向移动的现象。
②解释:胶体粒子具有相对较大的表面积,能吸附离子而带电荷。
③带电规律:
i. 一般来说,金属氧化物、金属氢氧化物等胶体微粒吸附阳离子而带正电;
ii. 非金属氧化物、金属硫化物、硅酸等胶体带负电;
iii. 蛋白质分子一端有-COOH,一端有-NH2,因电离常数不同而带电;
iv. 淀粉胶体不吸附阴阳离子不带电,无电泳现象,加少量电解质难凝聚。
④应用:
i.生物化学中常利用来分离各种氨基酸和蛋白质。
ii.医学上利用血清的纸上电泳来诊断某些疾病。
iii.电镀业采用电泳将油漆、乳胶、橡胶等均匀的沉积在金属、布匹和木材上。
iv.陶瓷工业精练高岭土。除去杂质氧化铁。
v.石油工业中,将天然石油乳状液中油水分离。
vi.工业和工程中泥土和泥炭的脱水,水泥和冶金工业中的除尘等。
(4)胶体的沉聚
①定义:胶体粒子在一定条件下聚集起来的现象。在此过程中分散质改变成凝胶状物质或颗粒较大的沉淀从分散剂中分离出来。
②胶粒凝聚的原因:外界条件的改变
i.加热:加速胶粒运动,减弱胶粒对离子的吸附作用。
ii.加强电解质:中和胶粒所带电荷,减弱电性斥力。
iii.加带相反电荷的胶体:相互中和,减小同种电性的排斥作用。通常离子电荷越高,聚沉能力越大。
③应用:制作豆腐;不同型号的墨水不能混用;三角洲的形成。
④凝聚和盐析的区别
实质不同:凝聚是胶体粒子聚集成大颗粒,而盐析是由于加入电解质后引起了溶解度的变小而析出。
变化过程不同:凝聚一般不可逆,而盐析可逆。
2.胶体的分类
按分散质的组成分为:
粒子胶体:如Fe(OH)3胶体,Al(OH)3胶体
分子胶体:如蛋白质溶于水所得分散系,淀粉溶于水所得分散系
按分散剂的状态分成:
液溶胶:如Na2SiO3溶于水所得分散系,肥皂水
固溶胶:有色玻璃
气溶胶:烟、云、雾
1.定义:分散质的大小介于1 nm-100 nm之间的分散系叫做胶体。
3.溶解度及相关计算
固体溶解度(S)指的是在一定条件下,100克溶剂中溶解某溶质达到饱和状态时所溶解溶质的克数叫做该条件下该溶质在该溶剂中的溶解度。

气体的溶解度是指在一定温度下,某气体(压强为1标准大气压)在1体积溶剂里达到饱和状态时所溶解的体积数。例如:0℃、1大气压下,氧气的溶解度为0.049,表示该条件下1体积水中最多能溶解0.049体积的氧气。气体的溶解度是没有单位的。(0℃时,NH3的溶解度是1176;20℃时为702)
物质溶解度的大小主要决定于溶质和溶剂的性质(内因),外界条件如温度、压强对物质的溶解度也有一定的影响(外因)。
(1)温度对固体物质溶解度的影响:
大部分固体物质的溶解度随着温度的升高而增大;少数物质(如食盐)的溶解度受温度的影响很小;还有极少数物质(如熟石灰)的溶解度随温度的升高而减小。
例1:40℃时等质量的两份饱和石灰水,一份冷却至10℃,另一份加少量CaO并保持温度仍为40℃。这两种情况都不改变的是( )
A.Ca(OH)2的溶解度 B.溶液的质量
C.溶液的质量分数 D.溶液中Ca2+数目
解析:正确答案为C。Ca(OH)2的溶解度随温度的降低而增大,故所给溶液冷却至10℃时,溶液变得不饱和,溶液的质量、质量分数,溶液中Ca2+数目皆不变;而加入CaO时发生反应CaO+H2O==Ca(OH)2,水量减少,因温度不变时溶解度不变,故有Ca(OH)2析出,溶液质量、Ca2+数目都减少,但仍为饱和溶液,质量分数不变。
(2)温度、压强对气体溶解度的影响:
气体的溶解度一般随着温度的升高而减小(如氨水受热逸出氨气);当温度不变时,随着压强的增大,气体的溶解度增大;随着压强的降低,气体溶解度减小。(如打开汽水瓶盖即冒气泡。)
例2:下列有关溶液性质的叙述,正确的是( )
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.20℃,100 g水中可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2%
C.强电解质在水中溶解度一定大于弱电解质
D.相同温度下,把水面上的空气换成相同压力的纯氧,100 g水中溶入氧气的质量增加
解析:正确答案选D。气体的溶解度一般随温度的升高而减小,故室温下CO2的饱和水溶液在降温到0℃时不会放出气体;20℃时34.2 g KCl溶于100 g H2O中所得饱和溶液的质量分数为 ×100%=25.5%;物质在水中溶解度的大小与电解质的强弱无必然联系,如CaCO3等难溶性盐虽为强电解质,但其溶解度不大,而CH3COOH等弱电解质在水中的溶解度却较大。水面上的O2与水面下的溶入氧存在溶解平衡,水面O2浓度增大,平衡向水面下溶入氧的方向移动,故100 g水中溶入O2的质量增加。
物质的溶解度和温度的关系,可用溶解度曲线来表示。纵坐标表示溶解度,横坐标表示温度,曲线上任何一点表示这种物质在该温度下的溶解度。
根据某物质的溶解度曲线可以查知这种物质在某温度时的溶解度,也可以看出这种物质的溶解度随着温度的变化而变化的规律,还可以比较温度相同时不同物质溶解度的大小。
一定条件下的饱和溶液中,溶质与溶剂的质量比是固定不变的,因此,对于一定条件下的饱和溶液有下列基本关系:
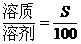
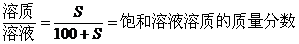
(1)温度不变时,饱和溶液蒸发溶剂或向饱和溶液中加入溶剂时,析出或溶解溶质(达到饱和)的质量x:

(2)若溶剂不变,改变温度,求析出或溶解溶质(达到饱和)的质量x:
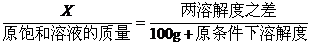
例3:把一定量20%的某物质的溶液加热蒸发掉10克水,在冷却到20℃时析出2克溶质,此时溶液的质量百分比浓度为24%,求20℃时溶质在水中的溶解度。
解析:设20℃时溶质在水中的溶解度为S,则: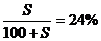 S=31.6克
S=31.6克
例4:一定温度下浓度为a%的硝酸钾溶液,将其等分为两份,一份等温蒸发掉10克水,得到0.5克晶体;另一份等温蒸发掉12.5克水,析出1.5克晶体。该温度下硝酸钾的溶解度为( )
A.60克 B.50克 C.40克 D.30克
解析:正确答案选C。蒸发溶液有晶体析出时,说明此时溶液已达饱和,第2份溶液比第1份溶液多蒸发掉2.5克水,多析出1克溶质,说明饱和溶液每蒸发掉2.5克水,析出1克溶质,所以: S=40克
S=40克
2.溶液的分类:
(1)按状态分
固体“溶液”:例如合金
液体“溶液”:例如水溶液
气体“溶液”:例如空气
(2)按饱和程度分
饱和溶液:一定温度下一定量的溶液不能再溶解某溶质时叫做这种溶质的饱和溶液。
不饱和溶液:一定温度下一定量的溶液还能继续溶解某溶质时叫做这种溶质的不饱和溶液。
1.概念:一种或几种物质分散到另一种物质里所形成的均一的稳定的混合物叫做溶液。
溶质:被溶解的物质(即分散质)
溶剂:能溶解其他物质的物质(即分散剂)。
说明:
(1)溶液是分散系中的一种,其分散质被分散成分子或离子,大小为1 nm以下。
(2)溶液的特点是:均一、稳定、多为透明。
(3)常用的溶剂:
无机溶剂:H2O,NH3(液),HF(液)等。
有机溶剂:C2H5OH,C2H5OC2H5,丙酮,苯,CCl4,氯仿(CHCl3),CS2,汽油等。
2.三种分散系比较
|
分散系 |
溶液 |
胶体 |
浊液 |
|
分散质微粒直径 |
<10-9m |
10-9m-10-7m |
>10-7m |
|
外观 |
均一、透明、稳定 |
多数均一、透明、稳定 |
不均一、不透明、不稳定 |
|
分散质微粒组成 |
单个分子或离子 |
分子集合体或有机高分子 |
许多分子集合体 |
|
能否透过滤纸 |
能 |
能 |
不能 |
|
能否透过半透膜 |
能 |
不能 |
不能 |
|
实例 |
食盐水、碘酒 |
肥皂水、淀粉溶液 |
泥水 |
1.分散系
物质的粒子分散于另一物质里所组成的体系叫分散系。其中被分散的物质称做分散质,分散其他物质的物质称做分散剂。即:分散系=分散质十分散剂
分散系包括:溶液、胶体和浊液。
3.溶液各种浓度的计算
(1)物质的量浓度与质量分数的换算公式:
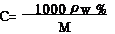
(2)物质的量浓度与溶解度的换算公式:
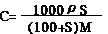
(3)不同物质的量浓度溶液的混合计算
① 稀释定律:C1V1=C2V2或m1W1=m2W2
②混合后溶液体积不变
C1V1+C2V2=C混(V1+V2)
③混合后溶液体积改变
C1V1+C2V2=C混V混
V混=m混/ρ混
(4)标准状况下求气体溶解于水中所得溶液的物质的量浓度的计算
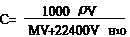
例6: 在标准状况下,1体积的水溶解700体积的氨气,所得溶液的密度为0.9 g/cm3,则该溶液的物质的量浓度为(水密度为1 g/cm3) ( )
A.18.4 mol·L-1 B.20.4 mol·L-1 C.31.25 mol·L-1 D.33.1 mol·L-1
解析:正确答案选A。水的体积和氨气的体积必须单位相同,如果以“L”为单位,则分别求出溶质的物质的量和溶液的体积,溶液物质的量浓度为18.4 mol·L-1。
例7:体积为VmL,密度为dg/cm3的溶液,含有式量为M的溶质mg,其浓度为C mol·L-1,质量分数为w%,下列表示式中正确的是( )
A.c=(w×100×d)/M
B.m=V×d×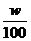
C.w%=(c×M)/(1000×d)%
D.c=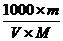
解析: 正确答案为B、D。
对A应为:c=(w%×1000×d)/M=(w×10×d)/M;对B溶质的质量为:m(溶质)=m(溶液)×ρ=(v×d)×w%;对C取1L溶液溶质的质量分数为:w%=[(c×M)/1000×d]×100%=[(c×M)/10×d]%;对D: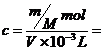
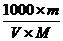 mol·L-1。
mol·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com