
4.离子反应的应用
(1)物质检验与含量测定:只要对其中特定的离子进行检验或测定即可,不必对物质的所有构成离子进行检验和测定。定量测定的方法包括酸碱中和滴定法、氧化还原滴定法、沉淀滴定法、络合滴定法等。
附:常见离子的检验
|
离子 |
所用试剂或操作 |
现象 |
相关方程式 |
|
NH4+ |
加浓碱液、△ |
产生刺激性气味气体,且使湿润红色石蕊试纸变蓝 |
NH4+ + OH– NH3↑+ H2O NH3↑+ H2O |
|
Mg2+ |
加过量NaOH溶液 |
产生白色沉淀 |
Mg2+ + 2OH– = Mg(OH)2↓ |
|
Al3+ |
加过量氨水,后加NaOH |
产生白色沉淀,加NaOH时沉淀溶解 |
Al3++3NH3•H2O = Al(OH)3↓+3NH4+ Al(OH)3+ OH–= [Al(OH)4]-+ 2H2O |
|
Fe2+ |
加NaOH溶液 |
产生白色沉淀,后迅速变灰绿,最终变红褐色沉淀 |
Fe2+ + 2OH– = Fe (OH)2↓ 4Fe (OH)2 + O2 + 2H2O = 4Fe (OH)3 |
|
Fe3+ |
加KSCN溶液 |
溶液变血红色 |
Fe3+ + SCN– = [Fe(SCN)]2+ |
|
Ag+ |
加NaCl溶液,后加稀HNO3 |
产物白色↓,加稀HNO3后不溶 |
Ag+ + Cl– = AgCl↓ |
|
Cl– |
加稀HNO3酸化的AgNO3溶液 |
产生白色沉淀 |
Ag+ + Cl– =
AgCl↓ |
|
Br– |
加稀HNO3酸化的AgNO3溶液 |
产生淡黄色沉淀 |
Ag+ + Br– =
AgBr↓ |
|
I– |
加稀HNO3酸化的AgNO3溶液 |
产生黄色沉淀 |
Ag+ + I– =AgI↓ |
|
SO42– |
加HCl酸化的BaCl2 |
产生白色沉淀 |
Ba2++SO42–= BaSO4↓ |
|
SO32– |
加盐酸后,产生气体,通入品红试液,加热 |
产生无色刺激性气味气体,且使品红试液褪色,加热后恢复原色 |
2H++ SO32–=SO2↑+H2O |
|
NO3– |
加Cu和浓H2SO4,加热浓缩 |
产生红棕色气体,溶液变蓝 |
Cu+2H2SO4(浓)+2NaNO3 CuSO4+Na2SO4+2NO2↑+2H2O CuSO4+Na2SO4+2NO2↑+2H2O |
|
PO43– |
加AgNO3溶液,后加稀HNO3 |
产生黄沉淀,加酸后沉淀溶解 |
3Ag++ PO43–=
Ag3PO4↓Ag3PO4+3H+=3Ag++H3PO4 |
|
CO32– |
加盐酸后,产生的气体通入澄清石灰水 |
产生无色气体,此气体能使澄清石灰水变浑浊 |
2H++CO32–=CO2↑+H2O Ca2++2OH–+CO2=CaCO3↓+H2O |
|
HCO3– |
加热,产生的气体通入澄清石灰水 |
产生无色气体,此气体能使澄清石灰水变浑浊 |
2NaHCO3 Na2CO3+CO2↑+H2O Ca2++2OH–+CO2=CaCO3↓+H2O Na2CO3+CO2↑+H2O Ca2++2OH–+CO2=CaCO3↓+H2O |
(2)物质的制备与纯化
(3)生活中的应用
3.离子反应方程式
离子反应方程式是用实际参加反应的离子所表示的在溶液中进行的反应,它体现了某一类反应的实质。
离子反应方程式的书写有如下两种不同的方法:
(1)"写、拆、删、查"四步法
①先写出正确的化学反应方程式。
②将方程式两边易溶于水易电离的强电解质改写成离子,单质、氧化物、沉淀、气体、弱电解质、非电解质则保留化学式。微溶于水的强电解质,若以溶液的形式存在,则改写为离子,若以浊液的形式存在,则应保留化学式;H2SO3、H3PO4通常也保留化学式。
③HSO4-可以拆写为H+和SO42-,也可以不拆写,多元弱酸的酸式酸根离子,一律不能拆写。如:HCO3-、H2PO4-、HPO42-、HS-等。
④删除两边没有参加反应的离子,化简各物质的系数成最简整数比,检查方程式两边各原子数是否平衡,电荷总数是否平衡。
(2)离子反应实质法
①分析反应物在水溶液中的存在形式。易溶于水、易电离的反应物写出其电离方程式;难溶于水、气体、难电离的物质写化学式。
②判断反应物存在形式的微粒哪些能相互作用生成沉淀、水、气体或者发生氧化还原反应。
③综合上述两步写出离子方程式并配平。
例3.下列离子方程式中不正确的是( ) A.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ B.碘化钾溶液跟适量溴水反应:2I-+Br2=I2+2Br- C.将金属钠加入水中:Na+2H2O=Na++2OH-+H2↑ D.将氯气通入氯化亚铁溶液中:2Fe2++Cl2=2Fe3++2Cl-
解析:检查离子反应方程式的书写是否正确是高考中的常见题型,考生应从如下四个方面展开思考:①明确哪些物质能“拆”,可写成离子形式(如A选项中的Ca(HCO3)2是易溶于水易电离的盐),哪些物质不能“拆”,必须写化学式; ②检查离子方程式是否配平时,要注意原子守恒和电荷守恒(C项方程式两边的电荷不守恒);③看反应是否能发生及是否符合反应的实际;④要有“量”的概念,即:一定物质的量的物质溶于水时电离出离子的种类及物质的量,发生反应的离子种类和物质的量。
答案:AC
2.离子反应的发生条件
(1)生成沉淀:熟悉常见物质的溶解性,如Ba2+、Ca2+、Mg2+与SO42-、CO32-等反应生成沉淀Ba2++CO32-=CaCO3↓、Ca2++SO42-=CaSO4(微溶);Cu2+、Fe3+等与OH-也反应生成沉淀如
Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等
(2)生成弱电解质:如OH-、CH3COO-、PO43-、HPO42-、H2PO4-等与H+发生反应: OH-+H+=H2O、CH3COO-+H+=CH3COOH;一些酸式弱酸根与OH- 反应:HCO3-+OH-=CO32-+H2O、HPO42-+OH-=PO43-+H2O;NH4++OH-=NH3·H2O等。
(3)生成气体(挥发性物质):如CO32-、S2-、HS-、HSO3-等易挥发的弱酸的酸根与H+ 常生成气体CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑。
(4)发生氧化还原反应:具有较强还原性的离子与具有较强氧化性的离子如I-和Fe3+ 发生2I-+2Fe3+=I2+2Fe2+;在酸性或碱性的介质中由于发生氧化还原反应如NO3-和I-在中性或碱性溶液中可以共存,但在有大量H+存在情况下则不能共存;SO32-和S2-在碱性条件下也可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共存。在原电池、电解池中的离子反应也属于这一类型。
(5)其它条件
还应注意有少数离子可形成络合离子的情况。如Fe3+和SCN-、C6H5O-,发生如下络合反应 Fe3++SCN- [Fe(SCN)]2+;能水解的阳离子跟能水解的阴离子(如Al3+和HCO3-、CO32-、HS-、S2-、ClO-)在水溶液中也能发生反应等。
[Fe(SCN)]2+;能水解的阳离子跟能水解的阴离子(如Al3+和HCO3-、CO32-、HS-、S2-、ClO-)在水溶液中也能发生反应等。
1.概念:溶液中离子之间,以及离子与原子或分子之间发生的反应称为离子反应。离子反应的共同特点是某种或某些离子浓度的降低。
2. 与金属的导电原理(通过内部自由电子的定向移动)不同,电解质溶液之所以能够导电,是因为溶液中存在自由移动的离子;在一定浓度范围内,溶液导电能力的强弱与溶液中离子的浓度有关:离子浓度越高,溶液的导电能力越强。
与金属的导电原理(通过内部自由电子的定向移动)不同,电解质溶液之所以能够导电,是因为溶液中存在自由移动的离子;在一定浓度范围内,溶液导电能力的强弱与溶液中离子的浓度有关:离子浓度越高,溶液的导电能力越强。
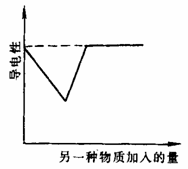
例2.如图是向不同电解质溶液中加入另一种物质后溶液导电性变化曲线,以下四个实验中,属于图中曲线的是( )。
A. 氢氧化钡溶液中滴加同浓度的硫酸至过量
B. 醋酸溶液中滴入氨水至过量
C. 澄清石灰水通入二氧化碳至过量
D. 氢硫酸中通入二氧化硫至过量
答案:AC
1.电解质溶于水或受热熔化时离解成自由移动离子的过程称为电离。
强电解质在水中完全电离,属不可逆过程,溶液中不存在强电解质的电离平衡:
HCl = H+ + Cl- Ba(OH)2 = Ba2+ + 2OH- (NH4)2SO4 = 2NH4+ + SO42-
弱电解质在水中部分电离,属可逆过程,溶液中存在弱电解质的电离平衡;弱电解质在水溶液中的电离趋势很小,并且,多元弱电解质的电离是分步进行的,书写弱电解质的电离方程式常用符号" ":
":
NH3·H2O NH4+ + OH-
NH4+ + OH-
H2CO3 H+ + HCO3- HCO3-
H+ + HCO3- HCO3- H+ + CO32-
H+ + CO32-
电解质溶液是电中性的,即阳离子所带的正电荷和阴离子所带的负电荷电量相等。
|
|
强
电 解 质 |
弱
电 解 质 |
|
概念 |
在水溶液中全部电离成离子的电解质 |
在水溶液中只有一部分电离成离子的电解质 |
|
电离程度 |
完全 |
部分 |
|
溶液里粒子 |
水合离子 |
水合分子、水合离子 |
|
物质结构 |
离子化合物、某些共价化合物 |
某些共价化合物 |
|
与常见物质类别的关系 |
通常为 强酸:HCl、H2SO4、HNO3等 强碱:NaOH、KOH、Ba(OH)2等 绝大多数盐:NaCl、CaCO3、CH3COONa等 |
通常为 弱酸:CH3COOH、HF、HClO、H2S、H2CO3、H2SiO3、H4SiO4等 弱碱:NH3·H2O、Cu(OH)2等 极少数盐、水 |
根据化合物在水溶液或熔化状态下能否导电,可将其划分为电解质、非电解质。电解质有强、弱之分,强电解质、弱电解质的本质区别在于它们在溶液中的电离程度不同。电解质在水中的溶解程度和电离程度可能不一致,在水中溶解程度大的不一定是强电解质(如醋酸),在水中溶解程度小的不一定是弱电解质(如硫酸钡)。
|
|
电 解 质 |
非
电 解 质 |
|
定
义 |
在水溶液中或熔化状态下能导电的化合物 |
在水溶液中和熔化状态下都不导电的化合物 |
|
相同点 |
都是与溶解性无关的化合物 |
|
|
不同点 |
在一定条件下能电离 |
不能电离 |
|
在水溶液中或熔化状态下能导电 |
在水溶液中和熔化状态下都不导电 |
|
|
与常见物质类别的关系 |
离子化合物和部分共价化合物 |
全是共价化合物 |
|
通常为酸、碱、盐、水、典型金属氧化物、某些非金属氢化物等 |
通常为非金属氧化物、某些非金属氢化物、绝大多数有机物等 |
例1.下列物质属于电解质的是( )
A.SO2 B.Cu C.氨水 D.NaCl E.NaOH F.HCl G.酒精 H.AgCl
解析:电解质应该是化合物,铜(单质)、氨水(混合物)不是电解质;电解质的导电条件是在水溶液里或熔化状态下,氯化银虽然其水溶液几乎不导电,但在熔化状态下导电,因此它是电解质;电解质导电必须是用化合物本身电离出自由移动的离子而导电,不能是发生化学反应生成的物质导电,如二氧化硫水溶液导电,是由于二氧化硫与水反应生成的亚硫酸能导电,所以二氧化硫不是电解质;蔗糖、酒精等化合物,无论是固态或其水溶液都不导电,这些化合物是非电解质。
答案:D、E、F、H。
6.常见的胶体分散系
①Fe(OH)3胶体,Al(OH)3胶体,原硅酸胶体,硬脂酸胶体。分别由相应的盐水解生成不溶物形成。
FeCl3溶液:Fe3++3H2O=Fe(OH)3(胶体)+3H+ 明矾溶液:Al3++3H2O=Al(OH)3(胶体)+3H+ 水玻璃:SiO32-+3H2O=H4SiO4(胶体)+2OH- 肥皂水:C17H35COO-+H2O=C17H35COOH(胶体)+OH-
②卤化银胶体。Ag++X-=AgX(胶体)
③土壤胶体。
④豆奶、牛奶、蛋清的水溶液。
⑤有色玻璃,如蓝色钴玻璃(分散质为钴的蓝色氧化物,分散剂为玻璃)。
⑥烟、云、雾。
5.提纯
利用渗析方法进行胶体的精制,即把混有离子或分子的胶体装入半透膜中,再将其放入溶剂中,使离子或分子通过半透膜进入溶剂里,由于胶体颗粒不能通过半透膜,从而得到纯净的胶体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com