
2.守恒规律
化合价有升必有降,电子有得必有失.对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,失电子总数(或共用电子对偏离)与得电子总数(或共用电子对偏向)相等。
1. 性质强弱的规律
|
|



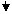

 在“氧化剂+还原剂 → 还原产物+氧化产物”中,氧化性强弱顺序是:氧化剂>氧化产物;还原性强弱顺序是:还原剂>还原产物。
在“氧化剂+还原剂 → 还原产物+氧化产物”中,氧化性强弱顺序是:氧化剂>氧化产物;还原性强弱顺序是:还原剂>还原产物。
例3.根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Br-+2Fe3+,可判断出离子的还原性从强到弱的顺序是( )。
A.Br-、Fe2+、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
解析:反应(1)中还原剂是I-,还原产物是Fe2+,故还原性I->Fe2+;反应(2)中还原剂是Fe2+,还原产物是Br-,故还原性Fe2+>Br-。综合起来可知还原性I->Fe2+>Br-。
答案:B
4. 电子转移的表示方法
(1)单线桥法。从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。例:

MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
|

MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
说明:注意两类特殊的化学反应。①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。例:
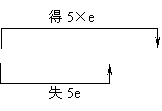 3Cl2+6KOH
3Cl2+6KOH KClO3+5KCl+3H2O
KClO3+5KCl+3H2O
 ②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例:
②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例:
|
|
|

 KClO3+6HCl
KClO3+6HCl 3Cl2+ 6KCl↑
+3H2O
Cl
Cl
Cl
3Cl2+ 6KCl↑
+3H2O
Cl
Cl
Cl

|
|
|

 若理解为右图则错了。
Cl Cl
Cl
若理解为右图则错了。
Cl Cl
Cl

3. 氧化还原反应
氧化还原反应
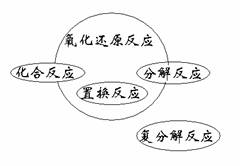
氧化还原反应与四种基本类型反应之间的关系
化合反应:有单质参加的是氧化还原反应。
分解反应:有单质生成的是氧化还原反应。
置换反应:全部是氧化还原反应。
复分解反应:都是非氧化还原反应。
(如图)
氧化还原反应的基本类型:
(1)自身氧化还原反应:同一种物质的分子内,同种元素(不同价态)或不同种元素的原子(离子)之间发生电子转移的氧化还原反应。
说明:自身氧化还原反应中氧化剂和还原剂必须是同一种物质。
(2)歧化反应:同一种物质分子内同一种元素同一价态的原子(或离子)发生电子转移的氧化还原反应。如:
C12+2NaOH=2NaCl+NaCl0+H20
3N02+H20=2HN03+NO
说明:①歧化反应是自身氧化还原反应的特例;②歧化反应的特点:某元素的中间价态在适宜条件下同时向较高和较低价态转化。
(3)归中反应:同种元素由不同价态(高价态和低价态)转变为中间价态的氧化还原反应。如:
6HCl+KCl03=KCl+3C12↑+3H20
2FeCl3+Fe=3FeCl2
2H2S+S02=3S+2H20
(4)部分氧化还原反应:不同物质之间,部分被氧化或部分被还原的氧化还原反应。
Mn02+4HCl(浓)=MnCl2+2H20+C12↑
2.常见的氧化剂和还原剂
(1)重要的氧化剂:
①活泼非金属单质:F2 、 Cl2、 Br2 、I2 、 O2、O3
②高价氧化物:MnO2、PbO2、 Bi2O5、 CO2(高温)
③高价态酸:HNO3、HClO3、HClO4、浓H2SO4
④高价态盐:KNO3(H+)、 KMnO4(酸性、中性、碱性)、 KClO3、FeCl3、K2Cr2O7(酸性、中性、碱性)
⑤过氧化物:H2O2、Na2O2、 CaO2、 BaO2、 K2O2
⑥其它:HClO、NaClO、漂白粉、NO2、KO2
⑦弱氧化剂:能电离出H+的物质、银氨溶液、新制的Cu(OH)2
(2)重要的还原剂:
①金属单质:IA、IIA、金属活动性顺序表靠前的金属
②非金属单质:H2、C、Si
③变价元素中元素低价态氧化物:SO2、CO
④变价元素中元素低价态的酸、阴离子:H2S、 S2-、HS-、HBr、Br-、HI、I-、浓HCl、Cl-、H2SO3 、HSO3-
⑤变价元素中元素低价态时的盐、碱:Na2SO3、Na2S、FeSO4、Na2S2O3、Fe(OH)2
⑥其它:S、Sn2+、NH3
1.氧化剂和还原剂的相关概念
氧化剂:得到电子(所含某元素化合价降低)的反应物;还原剂:失去电子(所含某元素化合价升高)的反应物。
氧化反应:失去电子(或元素化合价升高)的反应;还原反应:得到电子(或元素化合价降低)的反应。
氧化性:物质得到电子的能力或性质;还原性:物质失去电子的能力或性质。
氧化产物:氧化产物是发生氧化反应的物质的生成物;还原产物:还原产物是发生还原反应的物质的生成物。
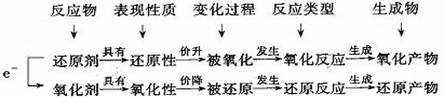
说明:①氧化剂和还原剂均是指反应物,是一种化学物质,而不是指某一种元素;②氧化剂具有氧化性,氧化剂本身被还原,即发生还原反应,转化为还原产物;还原剂具有还原性,还原剂本身被氧化,即发生氧化反应,转化为氧化产物(图示如下):
例2.在3Cu + 8HNO3(稀)= 3Cu(NO3) 2 + 2NO↑+ 4H2O的反应中,还原剂是__________,氧化剂是__________,还原产物是__________,氧化产物是__________,4molHNO3参加反应,其中被还原的是______mol。
解析:在8摩尔参加反应的硝酸中,所含N元素化合价降低的硝酸只有2摩尔,其余6摩尔的硝酸与铜成盐。所以硝酸在此反应中既表现了氧化性,又表现了酸性。提醒考生在做计算题时更应注意题目要求:对于只有一部分发生氧化(或还原)反应的反应物重点看反应前后化合价发生变化的占多少。
答案:Cu, HNO3,NO,Cu(NO3) 2,1。
3. 氧化还原反应的特征(判断依据)
反应前后某些元素的化合价发生了变化。
例1.氯化碘(ICl)的性质类似卤素,有很强的化学活动性。ICl跟Zn、H2O的反应如下:
①2ICl+2Zn=ZnCl2+ZnI2 ②ICl+H2O=HCl+HIO下列叙述中正确的是( )
A.反应①不是氧化还原反应
B.反应②不是氧化还原反应
C.二者都是氧化还原反应
D.在反应①中,Zn发生的是氧化反应
解析:结合题目所给信息,ICl与卤素单质最大的区别是:ICl属于化合物,共用电子对偏向于氯而呈-1价。根据化合价变化判断是否属于氧化还原反应不难看出反应②中所有元素的化合价均没有发生变化,不属于氧化还原反应。同时,需要指出的是,反应①中锌元素的化合价反应后升高了,发生了氧化反应,而碘元素的化合价从+1价降低到-1价,发生了还原反应。
答案:BD
2.氧化还原反应的实质
元素化合价的变化是电子转移的外观表现,电子转移是氧化还原反应的实质。
1.氧化还原反应的定义
在反应过程中有元素化合价变化的化学反应叫做氧化还原反应。在氧化还原反应中,反应物所含元素化合价升高的反应称为氧化反应;反应物所含元素化合价降低的反应称为还原反应。氧化反应和还原反应对立统一于一个氧化还原反应之中。
近几年高考几乎每年都设置判断离子共存问题的试题。从历年高考中有关离子共存问题的难度上分析,这类问题都属于中等难度偏易题,但这类题的区分度都比较高。离子共存与离子反应是一个问题的两个方面,离子不能共存必然是离子反应发生的结果,讨论离子共存也就是对离子反应发生条件的判断。另外,离子共存问题又比较综合,往往涉及多种离子之间的反应,有时还要考虑环境因素的影响。
例4.在pH=1的无色透明溶液中不能大量共存的离子组是( )
A.Al3+ Ag+ NO3- Cl- B.Mg2+ NH4+ NO3- Cl-
C.Ba2+ K+ S2- Cl- D.Zn2+ Na+ NO3- SO42-
答案:AC
解题说明:1.首先从化学基本理论和概念出发,理清离子反应的规律和“离子共存”的条件。在中学化学中要求掌握的离子反应规律主要是离子间发生复分解反应和离子间发生氧化反应,以及在一定条件下一些微粒(离子、分子)可形成络合离子等。“离子共存”的条件是根据上述三个方面统筹考虑、比较、归纳整理而得出。因此解决“离子共存”问题可从离子间的反应规律入手,逐条梳理。2.审题时应注意题中给出的附加条件:(1)酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-的浓度为
1×10-10mol/L的溶液等。(2)有色离子MnO4-(紫色)、Fe3+(黄色)、Cu2+(蓝色)、Fe2+(浅绿色)、Fe(SCN)2+(血红色)。(3)MnO4-,NO3-等在酸性条件下具有强氧化性。(4)S2O32-在酸性条件下发生氧化还原反应:S2O32-+2H+=S↓+SO2↑+H2O (5)注意题目要求“大量共存”还是“不能大量共存”。3.审题还应特别注意以下几点:(1)注意溶液的酸性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4- 与Cl-在强酸性条件也不能共存;S2-与SO32-在钠、钾盐时可共存,但在酸性条件下则不能共存。(2)酸式盐的含氢弱酸根离子不能与强碱(OH-)、强酸(H+)共存。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com