
8、下列四种有色溶液与SO2气体作用均能褪色,其实质相同的是 ( )
①品红溶液;②酸性高锰酸钾溶液;③溴水;④滴有酚酞的氢氧化钠溶液
A.①④ B.②③ C.①③ D.②④
7、下图是制取、洗涤并测量生成气体体积的装置示意图,利用该装置进行下表所列实验,能达到实验目的的是 ( )
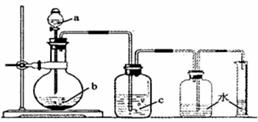
 物质 物质实验 |
a(液体) |
b(固体) |
c(液体) |
|
A |
稀硫酸 |
锌粒 |
浓H2SO4
|
|
B |
稀硫酸 |
石灰石 |
浓H2SO4 |
|
C |
浓硫酸 |
Cu片 |
NaOH溶液 |
|
D |
稀HNO3 |
Cu片 |
H2O |
6、下列各组离子在指定条件下一定不能大量共存的是 ( )
A.在加入铝粉能产生氢气的溶液中:NH4+、 Fe2+、SO42-、NO3-[来源:]
B.c (H+)=0.lmol·L-1的溶液中:Cu2+、A13+、SO42-、NO3-
C.能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2-
D.在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SO42-
5、
|
A.标准状况下,11.2 L SO3所含的原子数为2NA
B.标准状况下,22.4L氧气和乙炔混合物所含的分子数为NA
C.0.2 mol过氧化氢完全分解转移的电子数目为0.4 NA
D.100 mL 2.0 mol/L的Na2CO3溶液中阴离子个数小于0.2 NA
4、下列有关海水综合利用的说法正确的是( )
A.海水中含有碘单质,只需经过物理变化就可以得到碘
B.海水蒸发制海盐的过程中只发生了化学变化
C.经过化学变化可以从海水中获得镁
D.利用潮汐发电是将化学能转化为电能
3、下列化学用语书写正确的是( )
A.N2的结构式: B.CO2的分子模型:
B.CO2的分子模型:
C.四氯化碳的电子式: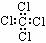 D.氧离子结构示意图:
D.氧离子结构示意图:
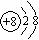
2、用右图表示的一些物质或概念间的从属关系中不正确的是 ( )
|
|
X |
Y |
 Z Z |
|
A |
甲烷 |
有机物 |
化合物 |
|
B |
空气 |
分散系 |
混合物 |
|
C |
酒精 |
含碳化合物 |
有机化合物 |
|
D |
Mn2O7 |
酸性氧化物 |
氧化物 |
1、目前有研究表明,过氧乙酸对甲型H1N1流感病毒有较好的杀菌作用,这主要是利用了过氧乙酸的 ( )
A.酸性 B.强氧化性 C.还原性 D.挥发性
3、周期表中部分规律总结
(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素;
最外层电子数为1或2的元素可能是主族、副族或0族(He)元素;
最外层电子数为8的元素是稀有气体元素(He例外)。
(2)同周期第ⅡA与ⅢA族元素的原子序数:
①第1-3周期(短周期)元素原子序数相差1;
②第4、5周期相差11;
③第6、7周期相差25。
(3)同主族相邻元素的原子序数:①第ⅠA、ⅡA族,上一周期元素的原子序数+该周期元素的数目=下一同期元素的原子序数;②第ⅣA-ⅦA族,上一周期元素的原子序数+下一周期元素的数目=下一周期元素的原子序数。
(4)由序数确定位置的方法:2He ,10Ne,18Ar ,36Kr, 54Xe,86Rn
纵列数=原子序数-比其小而相近的稀有气体元素的原子序数。
(5)除第Ⅷ族元素以外,原子序数为奇(或偶)数的元素,元素所在族的序数及主要化合价也为奇(或偶)数。
(6)若主族元素族序数为m周期数为n,则
当m/n<1时,为金属元素,m/n值越小,元素的金属性越强;
当m/n=1时,为两性元素(氢除外);
当m/n>1时,为非金属元素,m/n值越大,元素的非金属性越强
(7)周期表中特殊位置的元素
①族序数等于周期数的元素:H、Be、Al;
②族序数等于周期数2倍的元素:C、S;3倍的元素:O;
③周期数是族序数2倍的元素:Li; 3倍的元素:Na
④最高正价与最低负价代数和为零的短周期元素:C、Si;3倍的短周期元素:S;
⑤除H外,原子半径最小的元素:F;短周期中其离子半径最大的元素:S;
⑥最高正化合价不等于族序数的元素:O、F。
3、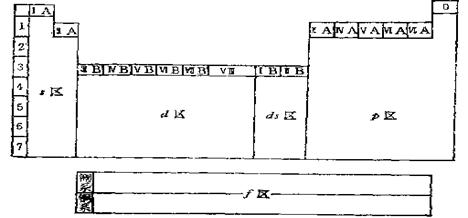 元素周期表分区
元素周期表分区
几个量的关系:
(1)原子序数=核电荷数=质子数 =核外电子数
(2)周期序数=核外电子层数=能级组数,每周期元素数目=该能级组容纳电子总数。
(3)族的序数=特征电子数之和
a.主族序数=最外层电子数=元素的最高正价数(F无正价,O一般也无正价)
b. ⅢB到ⅦB和Ⅷ族的第一列:最高能级组中的电子总数=族数 如:钪[Ar] 3d14s2
ⅠB和ⅡB:最外层电子数=族数 如: 铜 29Cu [Ar]3d104s1 铁[Ar]3d64s2
(4) 非金属元素|最高正价数|+|负价数|=8
实例:已知某元素在周期表中位于第五周期、ⅥA族位置上。试写出该元素的基态原子的电子排布式、元素的名称、符导和原子序数。
解:元素位于第五周期,故电子的最高能级组是第五能级组;元素是ⅥA族的,故最外层电子数应为6,故有5s25p4;ⅥA族属于p区,其4d一定是全充满的。电子结构式为[Kr]4d105s25p4,元素名称是碲,符导Te,核外共有52个电子,原子序数是52。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com