
1. (’08全国Ⅰ11)已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH =-1 025 KJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
(’08全国Ⅰ11)已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH =-1 025 KJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )

答案 C
解析 由于该反应为放热反应,升高温度平衡左移,NO的含量降低,因此A正确、C错;又由于该反应为气体体积增大的反应,增大压强平衡左移,因此压强越大,NO的含量越低,故B正确;而催化剂只能提高反应速率,不会引起平衡的移动,因此D正确。
12.(09海南卷 20)
20)

 20-1.下列有关肥皂的叙述中错误的是:
( )
20-1.下列有关肥皂的叙述中错误的是:
( )
 A.肥皂与纯碱的去污原理相同
A.肥皂与纯碱的去污原理相同
 B.肥皂可以加速油污在水中的分散
B.肥皂可以加速油污在水中的分散
 C.肥皂是油脂在碱性条件下水解生成的
C.肥皂是油脂在碱性条件下水解生成的
 D.肥皂主要成分的分子中含有亲油基团和亲水基团
D.肥皂主要成分的分子中含有亲油基团和亲水基团
 20-2.下列使用化肥、农药的描述中正确的是:
( )
20-2.下列使用化肥、农药的描述中正确的是:
( )
 A.高温多雨时比较适合施用钾肥
A.高温多雨时比较适合施用钾肥
 B.长期施用硫铵会造成土壤板结
B.长期施用硫铵会造成土壤板结
 C.石硫合剂必须与硫酸混合后才能施用
C.石硫合剂必须与硫酸混合后才能施用
 D.过磷酸钙必须经硫酸处理后才能施用
D.过磷酸钙必须经硫酸处理后才能施用
 20-3.下列有关硬水及其软化的说法中错误的是:
( )
20-3.下列有关硬水及其软化的说法中错误的是:
( )
 A.离子交换法可以软化硬水
A.离子交换法可以软化硬水
 B.硬水中含有较多Ca2+、Mg2+
B.硬水中含有较多Ca2+、Mg2+
 C.生产、生活使用的天然水必须经软化
C.生产、生活使用的天然水必须经软化
 D.加热可使暂时硬水中的Ca2+生成CaCO3沉淀
D.加热可使暂时硬水中的Ca2+生成CaCO3沉淀
 20-4
20-4  工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
 (1)氨催化氧化的化学方程式为
:
(1)氨催化氧化的化学方程式为
:
 (2)原料气中空气必须过量,其主要原因是
;
(2)原料气中空气必须过量,其主要原因是
;
 (3)将铂铑合金做成薄丝网的主要原因是
;
(3)将铂铑合金做成薄丝网的主要原因是
;
 (4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)
 答案
答案 20-1 A
20-1 A
 20-2 B
20-2 B
 20-3 C
20-3 C
 20-4
20-4 



 (2)提高氨的转化率和一氧化氮的转化率
(2)提高氨的转化率和一氧化氮的转化率
 (3)增大单位质量的催化剂与反应物的接触面积
(3)增大单位质量的催化剂与反应物的接触面积
 (4)
(4)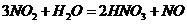 加压 降温
加压 降温
2008年高考题
11.(09上海卷 31)烟气中
31)烟气中 是NO和
是NO和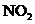 的混合物(不含
的混合物(不含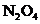 )。
)。
 (1)根据废气排放标准,
(1)根据废气排放标准,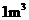 烟气最高允许含400mg
烟气最高允许含400mg 。若
。若 中NO质量分数为0.85,则
中NO质量分数为0.85,则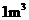 烟气中最高允许含NO__________L(标准状况,保留2位小数)。
烟气中最高允许含NO__________L(标准状况,保留2位小数)。
 (2)工业上通常用溶质质量分数为0.150的
(2)工业上通常用溶质质量分数为0.150的 水溶液(密度1.16g/mL)作为
水溶液(密度1.16g/mL)作为 吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L(保留2位小数)。
吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L(保留2位小数)。
 (3)已知:
(3)已知:  ①
①

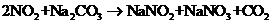 ②
②

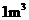 含2000mg
含2000mg 的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气_______排放标准(填“符合”或“不符合”),理由:____________________。
的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气_______排放标准(填“符合”或“不符合”),理由:____________________。
 (4)加入硝酸可改变烟气中NO和NO2的比,反应为:
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:
 NO+2HNO3→3NO2+H2O
NO+2HNO3→3NO2+H2O
 当烟气中
当烟气中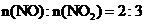 时,吸收率最高。
时,吸收率最高。

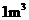 烟气含2000mg
烟气含2000mg ,其中
,其中 。
。
 计算:(i)为了达到最高吸收率,
计算:(i)为了达到最高吸收率,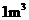 烟气需用硝酸的物质的量(保留3位小数)。
烟气需用硝酸的物质的量(保留3位小数)。
 (ii)
(ii) 烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
答案 (1)0.25
(1)0.25
 (2)1.64
(2)1.64
 (3)不符合 因吸收后烟气总体积减小,
(3)不符合 因吸收后烟气总体积减小, 含量仍超过
含量仍超过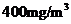
 (4)(i)
(4)(i)










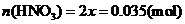
 (ii)
(ii)

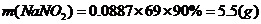
10.(09四川卷27) 已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。

请回答下列问题:
(1) 组成B单质的元素位于周期表第______________周期,第_______________族。化合物C的电子式为_________________________。
(2) J的沸点比硒化氢(H2Se)的沸点高,其原因是_________________。
(3) 写出I与H在点燃条件下反应生成A和J的化学方程式:________________。
(4) 写出D与足量的N反应生成E和F的化学方程式:_____________________。
(5) 上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有_______个。
答案
(1)三 II A 
(2)水分子之间存在氢键且比硒化氢的分子间作用力强
(3)
(4)
(5)2
9.(09北京卷27) 某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将 氧化成
氧化成 ,而稀硝酸不能氧化
,而稀硝酸不能氧化 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与 反应,能与
反应,能与 反应
反应

(1) 实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
(2) 滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(3) 装置①中发生反应的化学方程式是
(4) 装置②的作用是 ,发生反应的化学方程式是
(5) 该小组得出的结论依据的试验现象是
(6) 试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
a. 加热该绿色溶液,观察颜色变化
b. 加水稀释绿色溶液,观察颜色变化
c. 向该绿色溶液中通入氮气,观察颜色变化
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
答案 (1)3mol/L稀硝酸、浓硝酸、氢氧化钠溶液
(1)3mol/L稀硝酸、浓硝酸、氢氧化钠溶液
 (2)通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内
(2)通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内
 (3)Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O
(3)Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O
 (4)将NO2转化为NO 3NO2 +
H2O =2HNO3 + NO
(4)将NO2转化为NO 3NO2 +
H2O =2HNO3 + NO
 (5)装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
(5)装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
 (6)a c d
(6)a c d
8. (09全国卷Ⅰ29) 已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)Q的具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是
;
②电子总数相同的氢化物的化学式和立体结构分别是
;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 。
答案 (1)原子晶体。
(2)NO2和N2O4
(3)As2S5。
(4)①NH3> AsH3 > PH3,因为前者中含有氢键,后两者构型相同,分子间作用力不同;②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4
 解析 本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。
解析 本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。
(1)SiO2为原子晶体。
(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。
(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。R为As,所以R的最高价化合物应为As2S5。
(4)显然x为P元素。①氢化物沸点顺序为NH3> AsH3 > PH3,因为前者中含有氢键后两者构型相同,分子间作用力不同。②SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。
(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
7.(09宁夏卷7) 将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为 ( )
A.NO2 B.N2O2 C.N2O D.N2O4
答案 A
 解析 根据2NxOy+2yCu=2yCuO+xN2,以及题中数据反应后气体体积为反应前气体体积的一半,可以得到x=1,因此只有A选项符合题意。
解析 根据2NxOy+2yCu=2yCuO+xN2,以及题中数据反应后气体体积为反应前气体体积的一半,可以得到x=1,因此只有A选项符合题意。
6.(09上海卷 20)对于常温下pH为1的硝酸溶液,下列叙述正确的是
( )
20)对于常温下pH为1的硝酸溶液,下列叙述正确的是
( )
 A.该溶液lmL稀释至100mL后,pH等于3
A.该溶液lmL稀释至100mL后,pH等于3
 B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
 C.该溶液中硝酸电离出的
C.该溶液中硝酸电离出的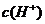 与水电离出的
与水电离出的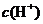 之比值为
之比值为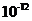 。
。
 D.该溶液中水电离出的
D.该溶液中水电离出的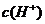 是pH为3的硝酸中水电离出的
是pH为3的硝酸中水电离出的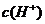 的100倍
的100倍
答案 AB
5.(09上海卷 7)在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
(
)
7)在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
(
)
 A.①②③
B.②①③
C.③②①
D.③①②
A.①②③
B.②①③
C.③②①
D.③①②
答案 A
4.(09上海卷4)用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.③④ C.③④ D.②④
答案 B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com