
4.(安徽省怀宁中学2010届高三3月月考)14.2g 69%的浓HNO3(密度为1.42g/cm3)与10mL 15.5 mol·L-1 HNO3的浓度相比
( )
A.是同一浓度的不同表示方法 B.数值不同,也能换算为相同值
C.不同浓度的两种硝酸溶液 D.无法比较其大小
答案 AB
3.(湖北省荆门市一中高三上学期期中考试)在室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量。则下列叙述不正确的是
A.在实验过程中水的电离程度的变化趋势是先减小后增大
B.当滴加盐酸至溶液pH=7时,此时溶液中,c(NH4+)=c(Cl-)
C.当滴加盐酸至溶液pH<7时,此时溶液中可能只有一种溶质
D.若滴加盐酸后,溶液pH >7,则此时溶液中溶质一定是NH4Cl和NH3·H2O
答案 A
2.(安徽省怀宁中学2010届高三3月月考)常温时,将V1mL c1mol·L-1的氨水滴加到V2mL c2moL·L-1的盐酸中,下列结论中正确的是 ( )
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则溶液中c (NH4+) = c (Cl-)
C.若混合溶液的pH=7,则溶液中c (NH4+)>c (Cl-)
D.若V1=V2,且混合液的pH<7,则可能有c1 = c2
答案 AD
1.(安徽省怀宁中学2010届高三3月月考)对于可逆反应N2(g)+3H2(g) 2NH3(g)+Q;Q > 0,下列研究目的和示意图相符的是
2NH3(g)+Q;Q > 0,下列研究目的和示意图相符的是
( )
|
|
A |
B |
C |
D |
|
研究目的 |
压强对反应的影响(P2>P1) |
温度对反应的影响 |
平衡体系增加N2对反应的影响 |
催化剂对反应的影响 |
|
图示 |
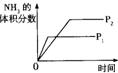 |
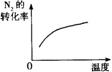 |
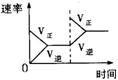 |
 |
答案 C
(三) 取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有。(3分)
6.(安徽省安庆一中2010届高三三模)氮的氧化物(用NOx表示)是大气污染物,必须加以处理。
(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应化学方程式可表示为:______________。
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3和NOx反应生成无毒的物质。某同学采用以下装置(见下图)和步骤模拟工业上氮的氧化物处理过程。
Ⅰ.提供的装置。

Ⅱ.NH3的制取。
①所提供的装置中能快速、简便制取NH3的装置是:__________(填仪器序号)。
②若采用C装置制取氨气(控制实验条件相同),情况如表所示。
实验记录
|
试剂组合序号 |
固体试剂/g |
NH3体积/mL |
|
a |
12.0g
Ca(OH)2(过量) 10.8g
NH4Cl |
2688 |
|
b |
12.0g
Ca(OH)2(过量) 10.8g(NH4)2SO4 |
2728 |
|
c |
12.0g
NaOH(过量) 10.8g NH4Cl |
3136 |
|
d |
12.0g
NaOH(过量) 10.8g
(NH4)2SO4 |
3118 |
|
e |
12.0g
CaO(过量)
10.8g NH4Cl |
3506 |
|
f |
12.0g
CaO(过量)
10.8g (NH4)2SO4 |
3584 |
分析表中数据,实验室制NH3产率最高的是:___________________(填序号),其他组合NH3产率不高的原因是:____________。
Ⅲ.模拟尾气的处理。
选用上述部分装置,按下列顺序连接成模拟尾气处理装置:

①A中反应的离子方程式:_________。
②D装置作用除使气体混合均匀和调节气流速度以外,还有一个作用是_____________。
③D装置中的液体可换成_________(填序号)。
a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是________________。
答案
7.(2010年福建省泉州市高三5月质检)
 磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。
磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。
回答下列问题:
(1)写出基态磷原子的电子排布式
(2)磷化硼的晶体类型是 ,B原子的杂化方式是 。
(3)电负性:N B (填“>”、“<”)
(4)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子。
(5)BBr3分子中,B原子采取sp2杂化,则BBr3属于 (填“极性”或“非极性”)分子
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是 。
答案(1)1s22s22p63s23p3 (2分)
(2)原子晶体;sp3 (各2分,共4分)
(3)> (2分)
(4)B (1分)
(5)非极性 (2分)
(6)磷原子的半径比氮原子大,N-P共价键键长比B-P小,键能大 (2分)
题组二
(二)(1)g→ab→ef→d (3分)
(2)在装置C和A之间连接一个盛有碱石灰的干燥管 (2分)
(3)3CuO+2NH3 △ 3Cu+N2+3H2O (2分)
(4)吸收尾气,防止倒吸;隔绝空气,防止空气中水蒸气进入D中(2分)
(三)提出并解决问题
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应。请你设计一个简单的实验检验该红色物质中是否含有Cu2O: 。
答案(一)(1)②⑤ (2分)
(2)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O (2分)
CaCl2+2NH3↑+2H2O (2分)
(二)实验探究
该小组成员设计实验探究氨气还原性及产物,提供实验装置如下:
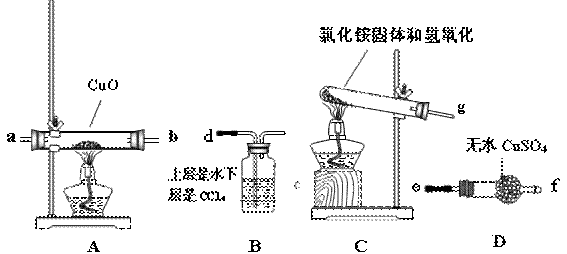
(1)请你根据提供的装置从左至右连接接口序号( )( )( )( )( )( )
(2)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是 。
(3)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式 。
(4)装置B的作用是: 。
(一)制取氨气
(1)实验室制备氨气,下列方法中适宜选用的是 (填编号)
①氯化铵溶液与氢氧化钠溶液共热;②固体氢氧化钠中滴加浓氨水;③固态氯化铵
加热分解;④固态硝酸铵加热分解;⑤固态氯化铵与熟石灰混合加热。
(2)写出实验室制取氨气的化学方程式 。
4.(安徽省安庆市2010届高三模拟题)合成氨工业的部分工艺流程如下图所示:

请你回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=–905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ;△H=–483.6kJ·mol-1
则N2(g)+3H2(g) 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。
(2)改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是_________。
A.增大压强 B.降低温度 C.使用催化剂 D. 增大反应物的浓度
(3)在一定条件下,将2molN2与5molH2混合于一个10L的密闭容器中,反应情况如右图所示: 图
①求5min内的平均反应速率v(NH3)=_______________
②达到平衡时NH3的体积分数为___________%
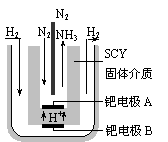 (4)近年来科学家提出了电解合成氨的方法:采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了高转化率的电解法合成氨(装置如右图)
(4)近年来科学家提出了电解合成氨的方法:采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了高转化率的电解法合成氨(装置如右图)
请回答:钯电极A是电解池的_______极(填“阳”或“阴”),该极上的电极反应式是_________________________
答案(1) -92.4kJ·mol-1
0.(2) AD
(3)04mol/(L·min) 40
(4) 阴 ; N2 + 6e-+6H+= 2NH3
5.(河南省豫南九校2010年高考仿真模拟)某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否象H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与活动并完成下列研究:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com