
14.(河南省南阳一中2010届高三第一次月考)
(1)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有:HF、NO、HNO3。写出该反应的化学方程式:__________ 反应过程中,被氧化与被还原元素的物质的量之比为__________________若反应中生成0.2molHNO3,转移的电子为_____________mol
(2)已知标准状况下1体积水能溶解500体积HCl,形成密度为ρg/ml的盐酸,则
所得溶液的物质的量浓度为_____________;
(3)下列物质中含有极性键的是 ,属于非极性分子的是 ,(用序号填空)
①CO2 ②H2O ③CH4 ④N2 ⑤H2 ⑥Na2O2 ⑦NaOH ⑧HF ⑨NH3
答案
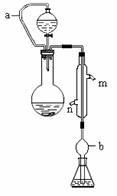
13.(广东省佛山市南海石门狮山2010届高三测试)(17分)实验小组测定某肥料中的总氮含量(以氮的质量分数表示) 。
称取1.200 g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在强碱性溶液中蒸馏氨,用25.00 mL浓度为0.5000 mol/L-1硫酸溶液充分吸收,实验装置如右图(图中加热及夹持仪器略去)。再用浓度为0.1000 mol/L-1氢氧化钠溶液滴定未反应的硫酸。重复上述实验三次。实验数据如下:
|
实验次数 |
氢氧化钠溶液的体积 |
|
|
滴定前刻度(mL) |
滴定后刻度(mL) |
|
|
1 |
0.00 |
5.22 |
|
2 |
0.00 |
5.18 |
|
3 |
0.00 |
5.20 |
(1)写出圆底烧瓶内发生反应的离子方程式 ________________________________。
(2)分液漏斗和圆底烧瓶之间的导管a的作用是_____________________________;
(3)本实验可以选择____________作为指示剂,到达滴定终点的现象为:____________________ 。
(4)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号)______________。
A. 锥形瓶水洗后未烘干
B.滴定前俯视滴定管,滴定后平时滴定管
C. 滴定过程中有少量溶液从锥形瓶中溅出
D. 滴定前没有用标准液润洗滴定管
若实验操作均正确,但测定结果偏低,可能造成该结果的主要原因是_________。
(5)利用题目中所给数据计算肥料中总氮含量为_______%(计算结果保留到小数点后1位)。
答案(1)NH4+ + OH- Δ NH3↑+H2O(2分)
(2)保证烧瓶和漏斗内压强恒定,有利于漏斗中的液体滴入锥形瓶中(2分);
(3)酚酞(或甲基橙)(2分);滴入最后一滴溶液,锥形瓶中溶液由无色变为浅粉红色(红色变为黄色),且30s内不变色。(3分)
(4)B D (4分,少选且正确得2分,只要错选不得分)
仍有氨气残留在装置中未被锥形瓶中的硫酸吸收(2分)
(5)28.6 %(2分)
12.(辽宁省沈阳二中2010届高三上学期期末考试)由第一、第二周期元素组成的几种物质,其组成分别如下:
①H2O、②H2O2、③CH3OH、④CO3、⑤NO2、⑥H2N-NH3(肼)、⑦F2。
回答下列问题:
(1)这些物质只具有18电子的分子有(填序号) 。
(2)若除去Na2SO4溶液中的Na2SO3,加入上述物质中的某种既环保,又不引进新的杂质。该物质的电子式为 。
(3)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
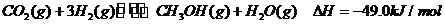
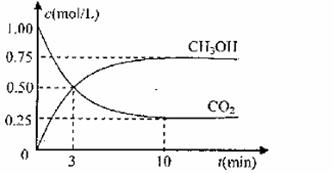 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH。
(4)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
N2H(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ/mol
1/2H2(g)+1/2F2(g)=HF(g) △H=-269kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=-242kJ/mol
发射卫星时可用肼(H2N-NH2)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。肼和二氧化氮反应的热化学方程式为 。
有人认为若用氟代替二氧化氮用氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式: 。
答案(1)②③⑥⑦
(2)H2O2的电子式
(3)①0.225,②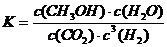 ,③C、D
,③C、D
(4)N3H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1153.7kJ/mol
N2H4(g)-2F2(g)=N2(g)+4HF(g)△H=-1135kJ/mol
11.(北京市东城区2010届高三综合练习)氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是 。
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该钠盐的化学式是 。
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1②CH4(g)+4NO2(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
根据①和②,标准状况下,4.48LCH4恰好将NO2
转化为N2时,△H= 。
关于①和②,下列说法正确的是 (填字母)。
a. 由于反应①可推知:
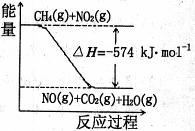 CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)
△H<-574kJmol
b. 等物质的量的甲烷分别发生反应①、②,
转移电子数相同
c. 右图可表示①的反应过程和能量关系
(4)同温同压下,3.5LNH3恰好将3.0L NO和NO2的混合气完全转化为N2,原混和气中NO和NO2的体积比是 。
答案(1)2周期VA族
(2)3Cu+8H++2NO-3=3Cu2++2NO↑+4H2O;NaNO2
(3)-173.4kJ·mol-1;ab
(4)1:3
10.(安徽身六安市第二中学2010届高三上学期第一次月考)在加热条件下发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行测定,测得如下数据:
|
物质 |
X |
Y |
Z |
Q |
|
反应前质量/g |
40.0 |
4.6 |
37.8 |
0.0 |
|
反应后质量/g |
43.6 |
待测数据 |
12.6 |
3.2 |
请回答下列问题:
(1)上表中“待测数据”的数值是 ,此密闭容器反应类型属于________(填基本反应类型)。
(2)若X是水,Y是氮的氧化物,且反应式的计量系数比n(X):n(Y):n(Z): n(Q)==2:4:4:1,写出化学反应方程式: 。
(3)反应结束后若将反应体系内的Y物质取出,在标准状况下测得其体积小于11.2L,其原因是 。
答案(1)23,分解反应 (2)4HNO3
 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
(3)因为2NO2  N2O4存在的平衡,有部分二氧化氮转化为四氧化二氮使体积变小。
N2O4存在的平衡,有部分二氧化氮转化为四氧化二氮使体积变小。
9.(北京市顺义区2010届高三一模)氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:
(1)实验室制取氨气的化学方程式是 。
(2)①右图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是 。
②氨气使烧杯中溶液由无色变为红色,其原因是_______________________________(用电离方程式表示)。
(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
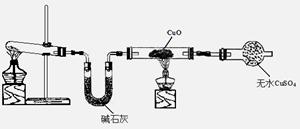
① 实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。
② 碱石灰的作用是 。
③该装置存在明显缺陷,请指出存在的问题并提出改进意见
。
 (4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ Cu + Cu2+)。
(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ Cu + Cu2+)。
请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
;
(5)工业废气中的氮氧化物是主要的大气污染物之一。为了治理污染,工业上常用氨气与之发生反应:NOx+NH3→N2+H2O,使其转化为无毒的N2 。现有NO2和NO的混合气体3.0 L,跟3.4 L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是__________。
答案(1)2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+2H2O (2分)
(2)①轻轻挤压滴管,是少量水加入烧瓶,然后打开止水夹K。(2分)
②NH3 + H2O  NH3·H2O
NH3·H2O
 NH4+ + OH- (2分)
NH4+ + OH- (2分)

 (3) ① 3CuO + 2NH3
3Cu + N2 + 3H2O (2分)
(3) ① 3CuO + 2NH3
3Cu + N2 + 3H2O (2分)
② 吸收氨气中混有的水蒸气,防止干扰产物水的测定。(2分)
③ 此装置无有尾气吸收装置,NH3排入大气,污染环境;(1分)
连接一个吸收氨气装置如右图所示:(合理即给分)。(1分)
(4)取少许样品于试管中,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O;反之则没有 (2分)
(5)7 : 3 (2分)
8.(湖北省荆门市一中高三上学期期中考试)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3 。则下列说法正确的是:
A.反应过程中,被氧化与被还原的元素的物质的量之比为2:1
B.NF3在空气中泄漏时不易被察觉
C.若NF3泄漏,可以用NaOH溶液喷淋的方法减少污染
D.若反应中生成1.0mol HNO3,转移的电子数目为6.02×1023
答案 C
7.(福建省龙岩市三校2010届高三上学期期末联考)用于净化汽车尾气的反应:2NO(g)+2CO(g) 2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
A. 装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B. 提高尾气净化效率的常用方法是升高温度
C. 提高尾气净化效率的最佳途径是研制高效催化剂
D. 570K时该反应正向进行的程度很大,故使用催化剂并无实际意义
答案 C
6.(吉林省通化一中2010届高三月考)稀硝酸作为较强氧化剂在溶液中发生的反应是: 2NO3-+8H++6e-=2NO↑+4H2O,下列离子能让此反应过程发生的是
①Fe2+;②Mg2+;③SO32-;④S2-;⑤I-;⑥ClO-。
A.①③④⑤ B.①②③④⑤⑥ C.②③④⑥ D.①③④⑥
答案 A
5.(河南省内乡一高2010届高三第一次月考)区别NO2和溴蒸气应当选用的试剂是( )
A.淀粉碘化钾试 B.硝酸银溶液 C.石蕊试液 D.酚酞试液
答案 B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com