
3.(重庆西南师大附中2010年高二上学期期末考试)在 – 50℃时,液氨和水一样,是一种极性溶剂,可发生如下电离:2NH3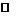 NH4+
+NH2-,两种离子的平衡浓度均为1×10-15mol/L,下列有关叙述正确的是( )
NH4+
+NH2-,两种离子的平衡浓度均为1×10-15mol/L,下列有关叙述正确的是( )
A.此温度下,液氨的离子积常数为1×10-15
B.保持温度不变,在液氨中放入NaNH2,则液氨离子积常数增大
C.保持温度不变,在液氨中加入NH4Cl固体,液氨电离程度减小,NH4+浓度增大
D.向NH4Cl的液氨溶液中,再加入一定量的溶剂液氨,各微粒浓度都减小
答案 C
2.(湖北省荆州中学2010年高一上学期期末考试)将盛有12mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是( )
①1.2mL ②2.4mL ③3.6mL ④4mL
A.①② B.①③ C.②④ D.①④
答案 D
1.(贵州省清华实验学校2010届高三上学期期末考试)常温下,向一定浓度的氨水中逐滴加入盐酸,在此过程中,下列说法正确的是 ( )
A.当pH>7时,c(Cl-)>c(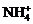 )>c(OH-) >c(H+)
)>c(OH-) >c(H+)
B.当pH=7时,c(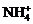 )>c(Cl-)>c(H+)=c(OH-)
)>c(Cl-)>c(H+)=c(OH-)
C.当pH<7时,c(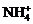 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
D.当氨水与盐酸恰好完全反应时,c(Cl-)>c(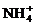 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
答案 D
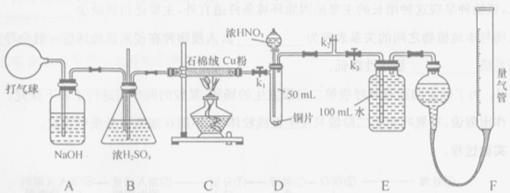
20.(山西省太原五中2010届高三4月月考)某化学兴趣小组欲设计使用如下装置验证:
铜和一定量的浓硝酸反应有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)
试回答下列问题:
(1)将铜粉分散在石棉绒中的原因是_________;
(2)在铜和浓硝酸反应前,挤压打气球,经A、B、C反应后,进入D中的气体是______(填化学式),通入该气体的目的是________;进行此步操作时应关闭_________,打开_________ (填k1、k2或k3);
(3)若C装置的硬质玻璃管中出现堵塞,则B中可能出现的现象是________;
(4)关闭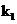 、
、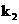 ,打开
,打开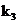 ,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入
,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入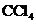 至满。则D中一定发生反应的离子方程式为:_________;
至满。则D中一定发生反应的离子方程式为:_________;
(5)若E中出现倒吸,可采取的应急操作是______;
答案(1)增大铜粉与氧接触面积,使反应迅速、充分(2分)
(2)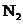 (1分)
排出D中的空气(1分)关闭
(1分)
排出D中的空气(1分)关闭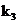 (1分)
打开
(1分)
打开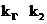 (1分)
(1分)
(3)锥形瓶中玻璃管液面上升(1分)
(4)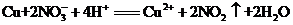 (2分)
(2分)
(5)向下调节量气管(或及时关闭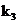 ) (1分,其他合理答案也可给分)
) (1分,其他合理答案也可给分)
(6)I.0.0720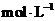 (2分)
(2分)
Ⅱ.有(1分) E装置中生成100mL、0.0720 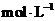 硝酸时产生的
硝酸时产生的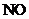 约为80.6mL,而试管中原有50mL
约为80.6mL,而试管中原有50mL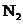 ,二者之和小于139.00mL,说明生成
,二者之和小于139.00mL,说明生成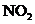 的同时有NO生成(2分)
的同时有NO生成(2分)
题组三
19.(云南省昆明三中2010届高三第七次月考)某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
a. NH4HCO3 b. NH4Cl c. Ca(OH)2 d. NaOH
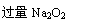
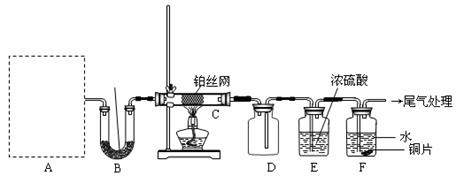
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是 (填代表备选试剂的字母);此时A中主要的玻璃仪器有 (填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式: 。
(3)对于C中发生的可逆反应,下列说法正确的 。
 a. 增大一种反应物的浓度可以提高另一种反应物的转化率
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
d. 使用铂丝网可以使正反应速率增大,同时也增大逆反应速率
(4)请在图16坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(5)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1 的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是 mol,甲在标准状况下是 L(忽略气体溶解)。
答案(1)a,试管、酒精灯(导管)。
(2)2Na2O2 + 2H2O = 4NaOH + O2↑或2Na2O2 + 2CO2 = 2Na2CO3 + O2
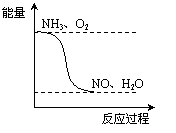
(3) a d (4)如右图 (5)0.25 ; 2.8
18.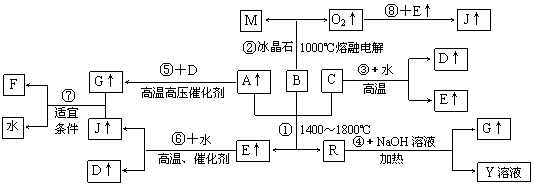 (贵州省云峰中学2010届高三3月月考)下图涉及多种无机化工反应,其中R是一种新型无机材料,M是一种应用广泛的金属材料,F是人工合成的第一种有机物, A、C、D、M均为常见元素的单质,“↑”表示该物质常温下是气体,反应G+J→F+H2O中G与J的最佳配比为2∶1,向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出洗净后加热分解可以得到B。
(贵州省云峰中学2010届高三3月月考)下图涉及多种无机化工反应,其中R是一种新型无机材料,M是一种应用广泛的金属材料,F是人工合成的第一种有机物, A、C、D、M均为常见元素的单质,“↑”表示该物质常温下是气体,反应G+J→F+H2O中G与J的最佳配比为2∶1,向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出洗净后加热分解可以得到B。
⑴试写出下列指定物质的化学式:D_________________,F_____________。
⑵反应①的化学方程式为___________________________________________。
⑶反应④的离子方程式为___________________________________________。
⑷上述反应中属于非氧化还原反应的有_____________(填写相应反应的序号)
答案⑴H2 CO(NH2)2
⑵N2+Al2O3+3C 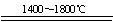
 3CO+2AlN
3CO+2AlN
⑶AlN+OH-+H2O=AlO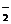 +NH3↑
+NH3↑
⑷④⑦
226.45 KJ (2分。漏写单位扣1分)
(3)C D E(各1分,共3分。若答对3个有多选,每多选一个扣1分,扣完三分止为)
(4)29.9%(3分)
17.(广西省桂林河池百色防城港四市2010届高三联考)下图是工业生产硝酸铵的流程示意图。
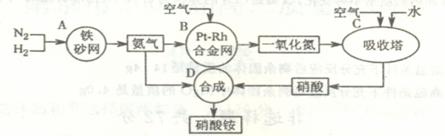
(1)吸收塔C中通入过量空气的目的是 。A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ;△H= 一1266.8kJ/mol
N2(g)+O2(g)=2NO(g);△H= +180.5 kJ/mol
依此写出氨高温催化氧化的热化学方程式: ,
若上述催化氧化过程转移了5mol电子,则反应的能量变化为 。
(3)已知:N2(g)+3H2(g)
 2NH3(g);△H= 一92 kJ/mol。
2NH3(g);△H= 一92 kJ/mol。
为提高氢气的转化率,宜采取的措施有 (填字母)。
A.适当升高温度 B.使用更有效的催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时分离出氨气
(4)在一定温度和压强下,将H2和N2按3∶1(体积比)在密闭容器中混合,当反应达到平衡时,测得平衡混合气中NH3的体积分数为17.6%,此时H2的转化率为 (计算结果保留一位小数)。
答案(1)使NO充分氧化为NO2(1分) A B C(各1分,共3分。若答对3个有多选,每多选一个扣1分,扣完三分止为)
(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g);ΔH = - 905.8KJ/mol (3分)
16.(江苏省栟茶高级中学2010届高三统考)以天然气为原料合成氨是新的生产氮肥的方法,它具有污染小、成本低等诸多特点,其过程大体如下:
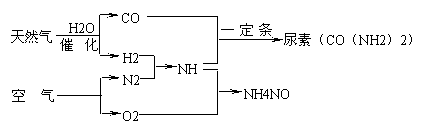
某工厂以标准状况下的含CH4 89.6%的天然气100 m3为原料经过上述过程,生产尿素和硝酸铵。
⑴ 合成氨生产过程中氨的产率为60%,假设其它各步反应均完全且不考虑副反应,求100 m3的天然气可生产尿素的质量。(注:产率为实际产量与理论产量之比)
⑵ 为使硝酸生产过程中不再补充空气,假设各步反应均完全且氨中氮元素全部转化为HNO3,空气中氧气的体积分数设为20%,求由氨气和空气组成的原料气中 (不包含被硝酸吸收的氨气)氨气与空气的体积比。
⑶ 实际生产中,若氨的产率为60%,硝酸的产率为80%,求100 m3的天然气最多可生产硝酸铵的质量。
答案(1)192kg(3分)
(2)1:10(3分)
(3)227.6kg(4分)
15.(福建省龙岩市三校2010届高三上学期期末联考)现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
(1)合成氨反应的化学方程式为1N2(g)+3H2(g) 2NH3(g),在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为 ,用氮气表示的反应速率为:
。反应的化学平衡常数K=
若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:
2NH3(g),在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为 ,用氮气表示的反应速率为:
。反应的化学平衡常数K=
若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:
(任意写一条)。
(2)在上述平衡中,若再加入2 mol NH3、2 mol N2,则此时反应平衡将_________移动。(填“向正方向”、“向逆方向”或“不”)。
(3)已知:0.01mol/L氨水溶液50ml与同浓度同体积的盐酸混合,则溶液中各离子浓度的大小为: 。若再往混合溶液中再加入0.01mol/L氨水溶液50ml,c(Cl-)-c(NH4+)=______________;(用溶液中微粒浓度表示等式)
(4)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.8 kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
氨催化氧化生成NO和水的热化学方程式为

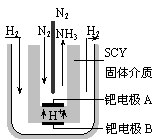 (5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)
(5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)
请回答:在电解法合成氨的电解池中 (填“能”或“不能”) 用水作电解质溶液的溶剂,原因是 。钯电极A是电解池的 极(填“阳”或“阴”),该极上的电应式是 。
答案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com