
4. (安徽省合肥168中学2010届高三复读年级第三次段考)氮化硅(Si3N4)是一种具有耐高温等优异性能的新型陶瓷。工业上可用下列方法制取:
(安徽省合肥168中学2010届高三复读年级第三次段考)氮化硅(Si3N4)是一种具有耐高温等优异性能的新型陶瓷。工业上可用下列方法制取:
3SiO2+6C+2N2 Si3N4+6CO。下列说法正确的是( )
A.氮化硅晶体熔点低
B.氮化硅中氮元素的化合价为―3
C.上述反应中,N2是还原剂,SiO2是氧化剂
D. 反应中,每生成1mol Si3N4,N2得到6mol电子
答案 B
3. (安徽省合肥168中学2010届高三复读年级第三次段考) 最近日本科学家确认世界还存在着另一种“分子足球” 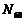 ,它与
,它与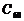 分子结构相似。
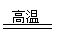
分子结构相似。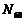 在高温和撞击后会释放出巨大能量。下列对
在高温和撞击后会释放出巨大能量。下列对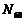 的说法不正确的是( )
的说法不正确的是( )
A.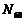 和
和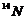 都是氮的同位素 B.
都是氮的同位素 B.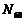 和
和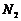 都是氮的同素异形体
都是氮的同素异形体
C.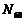 中氮原子之间由共价键结合 D.
中氮原子之间由共价键结合 D.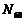 高温和撞击后应该生成
高温和撞击后应该生成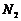
答案 A
2. (辽宁省开原高中五校联考2010届高三第三次月考)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3 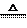 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2  7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是----------------------------------------------------------------------------------[ ]
A.C3N3(OH)3与HNCO为同一物质 B.反应中NO2是还原剂,HNCO是氧化剂
C.6mol NO2在反应中转移电子24mol
D.CO2是氧化产物,N2既是氧化产物又是还原产物
答案 C
1. (河南省方城五高2010届高三上学期期中考试)下列叙述正确的 ( )
A. 14N和15N具有相同的质量数 B. 14N和15N所含的电子数不同
C.N4和N2是同素异形体
D. 14N和N4互为同位素
答案 C
20.(河南省焦作市2010年高一上学期期末考试)某学生课外活动小组利用右图所示装置分别做如下实验:
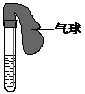 (1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是:___________________________________ ______
。
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是:___________________________________ ______
。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是 。
答案(4分)稀氨水+酚酞的混合溶液 加热时氨气逸出,导致溶液的红色变浅; (2) (4分)溶有SO2的品红溶液 加热时SO2气体逸出,品红溶液恢复红色。
题组四
19.(福建省宁德市部分达标学校2010年高二上学期期末联考)下图是工业合成氨的流程。
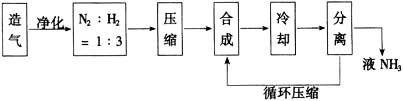
(1)已知::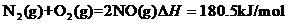
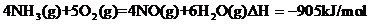
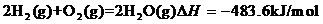
则N2(g)+3H2(g) 2NH3(g)的
2NH3(g)的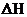 =__________________________。
=__________________________。
(2)为提高氢气的转化率,宜采取的措施有 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。在容积为2.0L的密闭容器中充入
2NH3(g)。在容积为2.0L的密闭容器中充入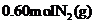 和
和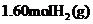 ,反应在一定条件下达到平衡时,NH
,反应在一定条件下达到平衡时,NH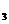 的物质的量分数(NH
的物质的量分数(NH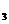 的物质的量与反应体系中气体总的物质的量之比)为
的物质的量与反应体系中气体总的物质的量之比)为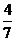 。计算
。计算
①该条件下N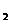 的平衡转化率为______________;
的平衡转化率为______________;
②该条件下反应2NH3(g)  N2(g)+3H2(g)的平衡常数为_____________。
N2(g)+3H2(g)的平衡常数为_____________。
答案(1)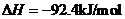 (2分)
(2分)
(2)C、D、E (选对一个给1分,共3分)
(3)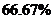 5×10-3(各2分)
5×10-3(各2分)
18.(上海市杨浦区2010届高三上学期期末学科测试)实验室可以通过以下三条途径按不同要求制取氮气:
①加热NaNO2(一种致癌物质,有剧毒)与NH4Cl的混合物浓溶液制取N2;
②将空气通过灼热的活性铜粉制得较纯净的N2;
③加热条件下用NH3还原CuO得纯净的N2和活性铜粉。
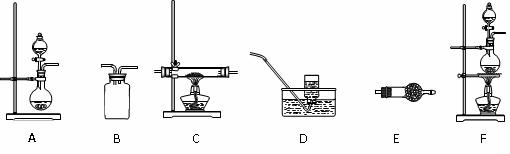
如图所示,给出了按上述途径制取N2可供选择的几种实验装置:
请回答下列问题:
(1) 按途径①制取N2时,应选用上述装置中的 (填装置代码,下同)做氮气发生装置。
(2) 按途径③制取N2时所需要的氨气可用浓氨水与生石灰作原料制取。为制取并收集较纯净的N2(只允许含少量的水蒸气),按气流从左到右的顺序列出所需的上述装置:
→ C → → → D。
甲同学:为通过实验现象验证C处有水产生,必须在C装置前后都连接E装置,其中填充的固体药品按前后顺序分别为 、 。
乙同学:实验过程中,发现黑色固体完全变红,质疑此时红色固体可能含Cu2O。通过查阅资料知,Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu(该反应的化学方程式为:Cu2O+2H+→Cu2++Cu+H2O)。依据信息,请设计实验证明C处的红色固体中是否含有Cu2O 。
丙同学:实验时充分加热,至C装置硬质玻管质量不再减轻为止。实验完毕后,若实验测得收集的N2体积为aL(已折算为标准状况),硬质玻管质量减轻了bg。则氨分子中氮、氢的原子个数比为(用含a、b的字母的代数式表示) 。
(3)上述三种制取N2的途径中,②和③两条途径常常被协同使用而越来越受到人们的关注,这种方法与途径①相比,优越性在于 。
答案(1)F(1分);
(2)A(1分);E(1分);B(1分)
碱石灰(或无水氯化钙) (1分),无水CuSO4(1分);
取样加入稀硫酸后溶液呈蓝色,即证明含Cu2O(2分)
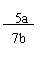 (2分);
(2分);
(答案也可用16a/22.4b 表示)
(3)活性铜粉可以循环使用;避免使用有毒物质,减少环境污染。(2分)
17.(辽宁省本溪市2010年高一模块结业考试)某大理石含有的主要杂质是氧化铁,以下是提纯该大理石的实验步骤:
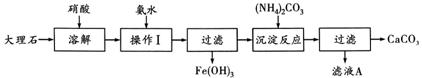
⑴ 溶解大理石时,用硝酸而不用硫酸的原理是:
。
⑵ 操作Ⅰ的目的是: ,该反应的离子方程式是:
。
⑶ 写出检验滤液中是否含有Fe3+的方法:
。
⑷ 写出加入(NH4)2CO3所发生反应的离子方程式:
,
滤液A的一种用途是 。
答案⑴ 硫酸钙微溶于水。
⑵ 除Fe3+离子;Fe3++3NH3·H2O = Fe(OH)3↓+3NH4+
⑶ 取少量滤液,向其中加入KSCN溶液不变色,说明不含Fe3+。
⑷ Ca2++CO32- = CaCO3↓ 做化肥。
15.(湖南省岳阳市一中2010届高三第四次月考)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题: (1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,
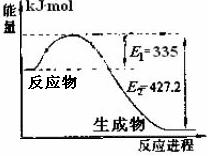 请计算每生成1molNH3放出热量为 。
(2)在固定体积的密闭容器中,进行如下化学反应:
请计算每生成1molNH3放出热量为 。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)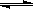 2NH3(g),其化学平衡常数K与t的关
2NH3(g),其化学平衡常数K与t的关
系如下表:
|
t/K |
298 |
398 |
498 |
…… |
|
K/(mol·L-1)-2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题: ①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。 A.容器内N2、H2、NH3的浓度之比为1:3:2 B.2v(N2)(正)= v(H2)(逆) C.容器内压强保持不变 D.混合气体的密度保持不变 (3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸
性,水解原理与NH4Cl类似。 ①写出盐酸肼第一步水解反应的离子方程式
。 ②盐酸肼水溶液中离子浓度的关系表示正确的是 (填序号)。 A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-) B.c(Cl-)>c([N2H5·H2O]+)>c(OH-)>c(H+) C.2c(N2H62+)+c([N2H5·H2O]+)+ c(H+) = c(Cl-)+c(OH-) D.c(N2H62+) > c(Cl-)> c(H+) >c(OH-)
答案 (1)46.1kJ
(2)> C
(3)①N2H62++H2O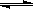 [N2H5·H2O]++H+ ②AC
[N2H5·H2O]++H+ ②AC
 16.(江苏省无锡市2010届高三上学期期末质量调研)下图是工业生产硝酸的流程。
16.(江苏省无锡市2010届高三上学期期末质量调研)下图是工业生产硝酸的流程。
合成塔中内置铁触媒,氧化炉中内置Pt – Rh合金。请回答下列问题:
(1)1909年化学家哈伯在实验室首次合成了氨。2007年格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:
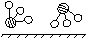
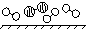
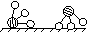
图① 图② 图③ 图④ 图⑤

分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别为 ,
。
(2)已知N≡N的键能是946kJ·mol-1,H-H的键能为436kJ·mol-1,N-H的键能为393kJ·mol-1,写出合成塔中发生反应的热化学方程式 。
(3)已知4NH3(g)+3O2(g)====2N2(g)+6H2O(g) △H=-1266.8kJ·mol-1;
4NH3(g)+5O2(g)====4NO(g)+6H2O(g) △H=-905.8kJ·mol-1;
则热化学方程式N2(g)+O2(g)===2NO(g) △H= kJ·mol-1。
(4)吸收塔中通入空气的目的是 。
答案(1)图②表示N2、H2被吸附在催化剂表面,图③表示在催化剂表面N2、H2中的化学键断裂。
 (2)N2(g)+3H2(g)
2NH3(g)△H=-104kJ·mol-1
(2)N2(g)+3H2(g)
2NH3(g)△H=-104kJ·mol-1
(3)+180.5
(4)使NO循环利用,全部转化成HNO3
14.(辽宁省本溪市2010年高一模块结业考试)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
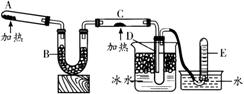
⑴ A 中装有氯化铵和氢氧化钙的混合物,发生反应的化学方程式是: 。
⑵ B 中加入的是碱石灰,其作用是 。
⑶ 实验时在 C 中观察到的现象是 ,发生反应的化学方程式是:
。
⑷ D 中收集到的物质是 ,检验该物质的方法和现象是 。
答案⑴
2NH4Cl+Ca(OH)2  CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
⑵ 除去氨气中的水蒸气。⑶ 黑色粉末逐渐变为红色;
3CuO+2NH3  3Cu+N2+3H2O
3Cu+N2+3H2O
⑷ 氨水;用红色石蕊试纸检验,试纸变蓝或使酚酞溶液变红。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com