
4. (安徽省萧城一中2010届高三第三次月考)神舟6号宇宙飞船是靠长征Ⅱ(F)型运载火箭发射升空的。该火箭所用的燃料是偏二甲肼[(CH3)2N-NH2]、氧化剂是N2O4,产物是氮气、二氧化碳和水。
(1)火箭点火瞬间,逸出的红棕色气体是
, 产生该气体的化学方程为
。
(2)偏二甲肼在N2O4中燃烧的化学方程式为:
,当有1mol偏二甲肼燃烧时,转移电子的物质的量为
。
肼(N2H4)也是一种火箭燃料,N2H4与NH3有相似的化学性质。
(3)写出肼与盐酸反应的离子方程式:
。
(4)发射火箭时以肼为燃料,二氧化氮为氧化剂,两者反应生成氮气和气态水,已知4g的N2H4(g) 在上述反应中放出 71KJ 的热量, 写出该反应的热化学方程式:
。
答案(1)NO2 N2O4≒2NO2
(2)(CH3)2N-NH2+2N2O4=3N2+2CO2+4H2O 16mol
(3)N2H4+2H+=N2H62+ 或N2H4+H+=N2H5+
(4) N2H4 (g)NO2(g)=3/2N2(g)+2H2O(g);△H= -568KJ/mol (答案合理即可)
3. (福建省港尾中学2010届高三上学期期中考试)电闪雷鸣是自然界中司空见惯的现象,地球上每年平均发生31万余次闪电。
(1)当电闪雷鸣之时,空气中会发生很多化学反应,试写出与氮元素有关的化学方程式。(至少三个)
(2)设某次雷电中放出的能量为1.5×107kJ,空气中的氮气和氧气直接化合,已知1 mol O2和1 mol N2化合时要吸收180.74 kJ的能量,闪电时有1/1 000的能量用于这一反应,那么:①此次闪电所产生的NO的物质的量有多少?②此次雷雨闪电的生成物相当于给土地施了多少尿素(CO(NH2)2)化肥?(提示:尿素的物质的量是NO的0.5倍)
答案

2. (辽宁省开原高中五校联考2010届高三第三次月考)实验室可以通过三条途径来制取氮气:
①加热条件下用NH3还原CuO制得纯净的N2和活性铜粉,反应的化学方程式为:
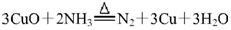
②将空气通过灼热的活性铜粉制得较纯净的N2
③加热NaNO2(有毒性)与NH4Cl的混合浓溶液制取N2,反应的化学方程式为:
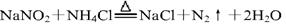
按上述途径制N2可供选择的实验仪器如下图所示,其他必要的仪器如铁架台、
铁夹、铁圈、石棉网、酒精灯等未列出。
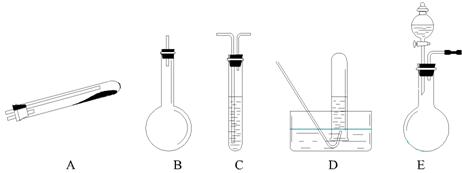
(1)按途径①制取N2时所需的氨气要用浓氨水与生石灰作原料制取,化学方程式为:
CaO+NH3·H2O===Ca(OH)2+NH3↑,最好要用上述仪器中的 (填仪器字母,
下同)作为氨气发生装置。要制取并收集纯净的N2(允许含少量的水蒸气),还应
使用到上述仪器中的 。
(2)①和②两种途径常常被协同使用。这种方法与途径 ③ 相比优点是
。
(3)检查 E 装置气密性的方法是 ,
。
利用 E 装置还可以制取的气体有 (写
出三种)。
答案(1) E 仪器中的 A、D或A、C、D 。
(2)优点是 Cu 和 CuO 可以循环使用,避免了使用有毒物质 。
(3)方法是 用止水夹夹紧E中乳胶管,向分液漏斗中加入适量水,
打开活塞,若最终液面保持恒定,则证明该装置不漏气 。
气体有 H2、O2、CO2、C12、SO2、NO2、 NO等 (写出三种)。
1. (贵州省坪东中学2010届高三上学期期中考试)氨可以形成多种离子,如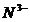 、
、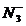 、
、 、
、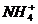 、
、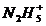 、
、 N4H44+等,已知
N4H44+等,已知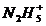 与
与 是由中性分子结合质子形成的,有类似于
是由中性分子结合质子形成的,有类似于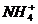 的性质。N4H44+,遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
的性质。N4H44+,遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
(1)1个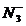 离子含有____________个电子,
离子含有____________个电子, 的电子式为______________。
的电子式为______________。
(2)形成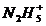 离子的中性分子的分子式是__________________。
离子的中性分子的分子式是__________________。
(3)写出 离子在强碱溶液中反应的离子方程式______________________
离子在强碱溶液中反应的离子方程式______________________
(4)N4和N2的关系正确的是___________(填序号)
(A)同种单质 (B)同位素 (C)同分异构体 (D)同素异形体
(5)N4H4(SO4)2 _____(填“能”或“不能”)和草木灰(主要成分为碳酸钾)混合施用。
 (6)已知液氨中存在着下列平衡:2NH3 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:
。
(6)已知液氨中存在着下列平衡:2NH3 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:
。
答案(1) 22 ; 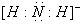 (2 )
N2H4
(2 )
N2H4
(3)
(4)D (5)不能
(6)8NH3 + 4CsOH = N4 + 4CsNH2 + 6H2↑+ 4H2
20. (广东省台山一中2010届高三12月月考)在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2 N2O4 △H < 0,若把烧瓶置于100℃的沸水中,下列情况中不变的是
N2O4 △H < 0,若把烧瓶置于100℃的沸水中,下列情况中不变的是
A.颜色 B.质量 C.压强 D.密度
答案 BD
19.
(广东省台山一中2010届高三12月月考)已知299 K时,合成氨反应
N2 (g ) + 3H2 ( g )  2NH3
( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3
( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A.一定大于92.0 kJ B.一定等于92.0 kJ C.一定小于92.0 kJ D.不能确定
答案 C
18.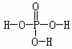 (福建省漳州三中2010届高三上学期第四次月考)磷酸的结构式如右图所示 ,磷酸分子与磷酸分子的羟基之间可以脱去水。三个磷酸分子可以脱去两个水分子生成三聚磷酸。含磷洗衣粉中含有三聚磷酸的钠盐(正盐),则该钠盐的化学式及1mol此钠盐中P-O单键的物质的量分别是: ( )
(福建省漳州三中2010届高三上学期第四次月考)磷酸的结构式如右图所示 ,磷酸分子与磷酸分子的羟基之间可以脱去水。三个磷酸分子可以脱去两个水分子生成三聚磷酸。含磷洗衣粉中含有三聚磷酸的钠盐(正盐),则该钠盐的化学式及1mol此钠盐中P-O单键的物质的量分别是: ( )
A.Na5P3O12 12mol B.Na3H2P3O10 9mol
C.Na5P3O10 9mol D.Na2H3P3O10 12mol
答案 C
17. (福建省同安一中2010届高三上学期期中考试)工业废气中氮的氧化物是重要的污染源,有一种治理污染的方法是通入适量氨气将其还原为无毒物质N2和H2O,现有含氮氧化物NO和NO2的混合气体3L,用同条件下的NH3 3.50 L恰好反应完全,则混合气体中NO和NO2的体积分数比为
A.1:4 B.1:3 C.1:2 D.1:l
答案 B
16. (上海市市北中学2010届高三理科班考试)将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,生成的盐溶液中NaNO3的物质的量为(已知:2NO2+2NaOH→NaNO2+NaNO3+H2O ,NO+NO2+2NaOH→2NaNO2+H2O。)
A.0.2 mol B. 0.4 mol C.0.6 mol D. 0.8 mol
答案 A
15. (上海市市北中学2010届高三理科班考试)氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主
(上海市市北中学2010届高三理科班考试)氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主
反应①和副反应②,有关物质产率与温度的关系如右图
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)+ 905 kJ ①
4NO(g)+6H2O(g)+ 905 kJ ①
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)+ 1268 kJ ②
2N2(g)+6H2O(g)+ 1268 kJ ②
下列说法中正确的是
A.工业上氨催化氧化生成 NO时,温度应控制在780-840℃之间
B.工业上采用物料比n(O2)/n(NH3)在1.7-2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g) 2NO(g)- 181.5 kJ
2NO(g)- 181.5 kJ
答案 AD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com