
18.(8分)钛在地壳中的含量比铜多61倍,排第十位。钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域。
由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):
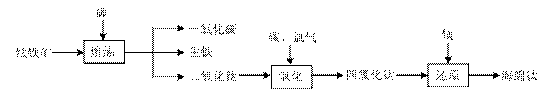
(1)氯化的过程为:将二氧化钛、炭粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性气体。该反应的化学方程式为 。
(2)还原过程为:用过量的镁在高温条件下与TiCl4反应制得海绵钛。
①写出此反应的化学方程式: 。
②简述如何从上述所得产物中获得金属钛?简述步骤并写出有关反应方程式。
(3)还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是 。
17.(8分)铜器锈蚀的结果会生成铜绿(碱式碳酸铜),孔雀石和石青是自然界存在的两种碳酸盐类铜矿。
(1)在潮湿的空气中,铜与空气中的二氧化碳、水和氧气等共同作用发生吸氧腐蚀,生成碱式碳酸铜,有关反应的电极方程式为: 。
(2)某种碱式碳酸铜的组成可表示为Cu2(OH)2CO3·xH2O,在加热条件下,发生分解的化学方程式为:Cu2(OH)2CO3·xH2O 2CuO+CO2↑+(x+1)H2O。现取该碱式碳酸铜样品,进行测量该样品(粉末)组成中碳的质量分数和结晶水x的值的实验。
2CuO+CO2↑+(x+1)H2O。现取该碱式碳酸铜样品,进行测量该样品(粉末)组成中碳的质量分数和结晶水x的值的实验。
现有下面几种仪器(必要的铁架台、铁夹、酒精灯、橡皮管等,均在图中略去)

用上述仪器进行组装并做实验时,按气流方向从左到右连接顺序是(用字母填写,下同)( )→( )→( )→(D)
(3)孔雀石和石青的化学组成可表示为:xCuCO3·yCu(OH)2(x、y为正整数且x≤2,y≤2)。孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4 :1;石青则为3 :1,请推算它们的化学组成。
孔雀石: ;石青: 。
16.某同学设计如下实验测量m g铜银合金样品中铜的质量分数:

下列说法中不正确的是( )
A.收集到的V L气体全为 NO
B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒
C.操作Ⅱ应是洗涤
D.铜的质量分数为: ×100%
×100%
第Ⅱ卷(非选择题 共52分)
15.分析推理是化学学习的方法之一。下列实验推理中,正确的是( )
A.金属的冶炼方法与金属的活泼性有很大关系,所以银和汞可以用热分解的方法冶炼
B.钠比铜活泼,所以钠可以从硫酸铜溶液中置换出铜
C.工业上电解熔融氯化镁可制得金属镁,所以工业上电解熔融氯化铝可制得铝
D.将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明镁比铝活泼
14.铝、铍(Be)及其化合物具有相似的化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低。已知反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是( )
A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
B.BeCl2溶液的pH>7,将其蒸干并灼烧后得到的残留物可能是BeCl2
C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D.BeCl2水溶液的导电性强,故BeCl2是离子化合物
13.将1.12 g铁粉加入到25 mL 2 mol·L-1的氯化铁溶液中,充分反应后其结果是( )
A.铁有剩余,溶液呈浅绿色,Cl-浓度保持不变
B.往溶液中滴无色KSCN溶液,溶液呈浅绿色
C.Fe2+和Fe3+的物质的量之比为6 : 1
D.氧化产物与还原产物的物质的量之比为2 : 1
12.黄铜矿(CuFeS2)中Fe的化合价为+2,工业上用黄铜矿冶炼铜的反应为:
8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
下列有关该反应的说法不正确的是( )
A.反应中被还原的元素只有氧
B.反应生成的SO2直接排放会污染环境
C.CuFeS2既是氧化剂又是还原剂
D.SO2既是氧化产物又是还原产物
11.下列化学反应的离子方程式正确的是( )
A.Al(OH)3与稀HNO3反应:Al(OH)3+3H+=Al3++3H2O
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++4OH-=AlO2-+2H2O
D.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
10.下列各组离子在指定条件下一定能大量共存的是( )
A.能使蓝色石蕊试纸变红的溶液中: Cu2+、A13+、SO42-、NO3-
B.能使碘化钾淀粉试纸变蓝的溶液中: Fe2+、NH4+、Cl-、Br-
C.由水电离出的c(H+)=10-2 mol·L-1的溶液中:Na+、Mg2+、Cl-、HCO3-
D.在含有大量 Fe3+的溶液中:NH4+、Na+、I-、SCN-
9. 著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是( )
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是( )
 A.铈的冶炼步骤为:用稀土串级萃法对矿石进行筛选富集;电解熔融CeO2
A.铈的冶炼步骤为:用稀土串级萃法对矿石进行筛选富集;电解熔融CeO2
 B.CeO2铈溶于氢碘酸的化学方程式可表示为:CeO2+4HI=CeI4+2 H2O
B.CeO2铈溶于氢碘酸的化学方程式可表示为:CeO2+4HI=CeI4+2 H2O
 C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.铈能从硫酸铜溶液中置换出铜:Ce+2Cu2+=2Cu+ Ce4+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com