
1.下列说法中正确的是
A.布朗运动是液体分子的坛,它说明分子永不停息地做无规则运动
B.当分子间距等于r0时,分子势能一定为零
C.温度相同时,分子质量不同的两种气体,其分子的平均动能不相同
D.满足能量守恒定律的客观过程并不是都可以自发地进行
1.两种微观模型
(1)球体模型(适用于固、凝体):一个分子的体积 --分子的__________________
--分子的__________________
(2)立方体模型(适用于气体):一个分子平均占据空间: --分子间的__________________
--分子间的__________________
自测自查
4.热力学定律
(1)热力学第一定律
做功和热传递都可以改变物体的内能,功、热量和内能之间的关系可根据热力学第一定律,其表达式为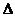 U+Q+W.
U+Q+W. 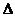 U、Q、W的符号规定为:
U、Q、W的符号规定为:
外界对系统做功,W>0,即W为正值;
系统对外界做功,也就是外界对系统做负功,W<0,即W为负值。
外界对系统传递热量,也就是系统________________热量,Q>0,即Q为正值。
外界对系统吸收热量,也就是系统对外界放出热量,Q<0,即Q为负值。
系统内能增加,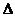 U>0,即
U>0,即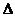 U为正值;
U为正值;
系统内能减少,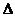 U<0,即
U<0,即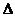 U为负值。
U为负值。
(2)对于理想气体来说,只要________不变,则内能不变。
(3)热力学第二定律
热力学第二定律的表述:①不可能使热能由低温物体传递到高温物体,而不引起其他变化(按热传导的_________性表述。)②不可能从单一热源吸收热量并把它全部用来做功,而不引起其他变化(按机械能和_________转化过程的方向性表述)。③第二类永动机是________的。
思路和方法
3.理想气体和气体的实验定律
(1)理想气体的分子模型:理想气体是为了研究问题的方便而建立的一种理想化模型。其微观模型是:分子本身无大小;分子间除碰撞外不计分子之间的相互作用力,无分子势能,内能只与温度有关;分子间的碰撞看成_________碰撞。
(2)玻意耳定律
内容:一定质量理想气体,在温度保持不变时,它的压强和体积成反比;或者说,压强和体积的______________保持不变,此即玻意耳定律。
数量表达式: 。
。
(3)查理定律
内容:一定质量的理想气体,在体积不变的情况下,它的压强跟____________成正比,这个规律叫做查理定律。
数学表达式:
对于一定质量的理想气体,在两个确定的状态I(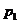 、
、 、
、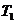 )和Ⅱ(
)和Ⅱ( 、
、 、
、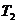 )下有
)下有
(4)盖·吕萨克定律
内容:一定质量的理想气体在压强不变的情况下,它的体积跟_________成正比。
数学表达式:
2.晶体和液晶
(1)晶体的主要特点表现为:①具有规则的几何形状;②具有________性;③有一定的熔点,晶体和非晶体并不是绝对的,它们在适当的条件下可以相互转化。
(2)液晶(或者称为液态晶体)是一种特殊的物质状态,所处的状态介于_______态和_______态之间。液晶的物理性表现为:①液晶具有液体的___________性;②液晶具有晶体的光学_____________性。它的应用主要表现在显示技术、电子工业、航空工业、生物医学等多方面。
1.分子动理论
(1)分子动理论的基本观点是:物体是由大量分子组成的,分子在做______________运动,分子间存在着_______________和_________.扩散现象与________________是分子永不停息地无规则运动的实验基础.每个分子的运动都不是规则的,带有偶然性,大量分子的集体行为受统计规律支配,表现为“________________”的规律,布朗运动既不是固体分子的运动,也不是液体分子的运动,它是由于_____________频繁地撞击固体小颗粒而引起的小颗粒的运动。
(2)温度是分子_________________的标志,物体的内能是物体内所有分子的动能和______________之和。
(3)阿伏加德罗常数
①分子的大小:直径数量级为_________m
②分子的质量:质量数量级为10-26 kg
③阿伏加德罗常数NA=6.02×1023 mol-1
NA= (适用于____________情况)
(适用于____________情况)
NA= (适用于____________)
(适用于____________)
④油膜法测分子的直径: =_____________
=_____________
21.(8分)镁与一定浓度的稀硝酸反应时,硝酸的还原产物为NH4NO3。现将一定量的镁粉投入200 ml 稀硝酸中,两者恰好完全反应。若向反应后的溶液中加入过量的浓NaOH溶液并微热,溶液中有白色沉淀的生,同时有氨气逸出,且逸出的氨气全部被稀硫酸吸收,稀硫酸增重0.17g 。试回答下列问题:(已知:4Mg+10HNO3===4Mg(NO3)2+NH4NO3+3H2O)
(1)发生还原反应的硝酸的物质的量为________________mol。
(2)参加反应的镁的质量为___________________g。
(3)原稀硝酸的物质的量浓度为_________________________ mol·l-1。
20.(8分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为:____________________________________。
(2)在一定体积的10 mol·l-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100ml。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
___________________________________________________________________________.
(3)根据下图操作及现象推断酸X为______________(填序号)。

a、浓盐酸 b、浓硫酸 c、浓硝酸
19.(9分)已知X气体是一种无色有刺激性
气味的酸性氧化物,有关X、Y、Z、W的转化
关系如下,反应①-④均为化合反应。回答下列问题:
(1)Y的化学式为___________,
 Z的化学式为____________。X直接排入空气中
Z的化学式为____________。X直接排入空气中
易造成的环境问题是_______________________。
(2)反应①-⑤中属于可逆反应的是
 ___________________,属于氧化还原反应的是
___________________,属于氧化还原反应的是
_______________________________________。
(3)写出反应⑤的化学方程式:_______________________________________________。
18.(7分)黏土是很多硅酸盐产品的原料之一,创造历史、享誉全球的景德镇陶瓷就是利用了当地的优质黏土资源。请回答下列问题:
(1)黏土主要有效成分的化学式为AL2Si2Ox(OH)4,其中x的值是______,若以氧化物形式表示,应写为_____________________。
(2)在黏土资源丰富的地区还可以兴建水泥厂、玻璃厂、硫酸厂等,这些工厂中属于硅酸盐工业的有____________________________,玻璃厂生产雕花玻璃过程所依据的化学原理是
________________________________________(用化学方程式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com