
21.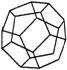 (5分)德国和美国科学家首次制造出了由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成的(如图所示)。请回答:
(5分)德国和美国科学家首次制造出了由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成的(如图所示)。请回答:
C20分子中共有 个正五边形,共有 条棱边。
C20晶体属于 (填晶体类型)。
20.(8分)有下列转代关系:
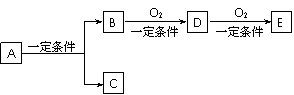
(1)若C是可用来自来水消毒的气体,D、E是氧化物,D能化为E时增加氧的质量是总质量的25.8%,则A是 (写化学式)并写出A在一定条件下生成的C的化学方程式 。
(2)若E是酸酐,且为无色易挥发的晶体,A为气态氢化物,则A与D反应生成B的化学方程式为 。
(3)若C是水,B是无氧化合物,且在同系物中是相对分子质量最小的化合物;E能使紫色石蕊试液显红色,则A的结构简式为 。A、B、D、E中易溶于水的是 。(写结构简式)
(4)写出(3)中下列反应的化学方程式,注明反应类型:
D→E 反应类型为__________。
19.(10分)下表是部分短周期元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
Q |
|
原子半径/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.110 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2、+4 |
-3、+5 |
试回答下列问题:
(1)五种元素中原子半径最大的元素在周期表中位置是 。
(2)Y的氢化物比Q的氢化物沸点高的原因是 。
(3)X或与R按1∶1的原子个数比形成化合物甲,甲中存在的化学键有 ;X可与W组成含18e-的化合物乙,则乙的电子式为 ;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键。1 mol
丙气体可与2 mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式 。
18.(10分)以下是有关SO2、Cl2的性质实验。
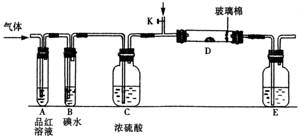 (1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若置D装的是铁粉,通入Cl2与铁粉充分反应时现象为
;若装置D中装的是五氧化二钒(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为 。
②若装置B中装有5.0 mL 1.0×10-3mol/L在碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,该反应的化学方程式为 。
③E中盛有 溶液。
(2)某同学将足量的SO2通入一支装有氧化钡溶液的试管,未见沉淀生成,若向该试管中加入加量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2的与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
17. (5分)某同学想通过比较两种最高价氧化物对应水化物的酸性强弱来验证硫与碳的非金属性的强弱,他采用了如图所示的装置。请回答:
(5分)某同学想通过比较两种最高价氧化物对应水化物的酸性强弱来验证硫与碳的非金属性的强弱,他采用了如图所示的装置。请回答:
(1)仪器a的名称是 ,应盛放下列药品中的 。
A.稀硫酸 B.亚硫酸
C.氢硫酸 D.盐酸
(2)仪器b的名称是 ,应盛放下列药品中的 。
A.碳酸钙 B.硫酸钠
C.氯化钠 D.碳酸钠
(3)如果观察到C中的现象为 ,即可证明硫与碳的非金属性的强弱。
16.下列化学方程式或离子方程式不正确的是( )
A.S与Cu反应 Cu+S CuS
CuS
B.酸雨放置过程中pH变小 2H2SO3+O2═2H2SO4
C.亚硫酸氢钙溶液与澄清的石灰水混合  ═CaSO3↓+H2O
═CaSO3↓+H2O
D.向Na2S和Na2SO3的混合溶液中滴加稀H2SO4 [n(Na2S)∶n(Na2SO3)=2∶1]
 ═3S↓+3H2O
═3S↓+3H2O
第Ⅱ卷(非选择题,共60分)
15.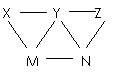 现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生反应。下列判断不合理的是( )
现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生反应。下列判断不合理的是( )
A.X一定为H2SO4
B.Y一定为K2CO3
C.Z可能为氯水
D.M、N必定各为BaCl2、FeSO4中的一种
14.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。
 常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红溶液褪色的气体。下列说法中错误的是( )
常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红溶液褪色的气体。下列说法中错误的是( )
A.S2Cl2的结构式Cl-S-S-Cl
B.S2Cl2的含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可为2S2Cl2+2H2O═SO2↑+3S↓+4HCl
13.检验某未知溶液是否含有 ,下列操作最合理的是( )
,下列操作最合理的是( )
A.加入HNO3酸化的Ba(NO3)2溶液
B.加入盐酸酸化的BaCl2溶液
C.先用盐酸酸化,若有沉淀产生,过滤,在滤液中再加BaCl2溶液
D.先加BaCl2溶液,若有沉淀产生,再加盐酸
12.下列反应中,调节反应物用量或浓度,不会改变反应产物的是( )
A.铁在硫蒸气中燃烧 B.H2S在空气中燃烧
C.二氧化硫通入澄清石灰水 D.硫酸中加入锌粉
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com