
1.2009年10月1日晚,北京天安门广场焰火晚会绚丽多彩,晚会所用的烟花很多是我省浏阳生产的。下列各组物质不可能是制造烟花配方的是
A.KNO3、Ba(NO3)2、炭粉、硫粉 B.KClO3、 Sr(NO3)2、炭粉、镁粉
C.Cu(NO3)2、KNO3、炭粉、硫粉 D.CaCO3、 Na2CO3、 SiO2
10.将铜、铁、锌三种金属(按等质量混合)的混合物W克,加入FeCl3和盐酸的混合液中,充分反应后,关于Fe3+、H+、Fe2+、Zn2+、Cu2+是否共存于溶液中,讨论如下:
(1) 若无固体剩余,则溶液中一定有Fe2+、Zn2+、Cu2+、H+,可能还有Fe3+。
(2)若剩余固体粉末为W/3克,则溶液中一定有Fe2+、Zn2+,可能还有H+,一定没有Fe3+
Cu2+。
(3)若未反应的固体粉末为3W/4克,则溶液中一定有Zn2+,一定没有Fe3+、H+、Fe2+、Cu2+。
9、向100mL 3mol·L-1硫酸铝铵[(NH4)Al(SO4)2]溶液中逐滴加入1mol·L-1Ba(OH)2溶液。
⑴写出当刚好出现沉淀的总物质的量为最大值时的离子方程式(用一个式子表示):
Al3++2SO42-+NH4++2Ba2++4OH-===Al(OH)3↓+2BaSO4↓+NH3·H2O;
⑵随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图表示。写出B点和C点所对应的Ba(OH)2溶液的体积:B600ml,C750ml。

8、NaBH4作为还原剂,在有机化学中有极为广泛的用途。
⑴NaBH4极易溶于水并与水作用产生H2,反应后硼元素以BO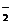 形式存在于溶液中,此反应的离子方程式为: BH
形式存在于溶液中,此反应的离子方程式为: BH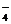 +2H2O=BO
+2H2O=BO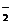 +4H2↑。
+4H2↑。
⑵该反应与溶液酸碱度有关,pH越小,反应速率越快,其原因是_因为NaBH4与水反应的实质是OH-与H+反应,pH值越小,反应速率越大。
⑶NaBH4可使许多金属离子还原为金属单质。例如它可以使含有金离子(Au3+)的废液中的Au3+还原(碱性条件,此时硼仍以BO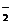 形式存在),离子方程式为8Au3++3BH
形式存在),离子方程式为8Au3++3BH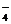 +24OH-=3BO
+24OH-=3BO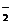 +8Au+18H2O。
+8Au+18H2O。
7、某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Fe3+、Ba2+、Al3+、
AlO2-、S2-、SO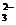 、SO
、SO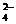 ,现取该溶液进行有关实验,实验结如下:
,现取该溶液进行有关实验,实验结如下:
 (1)沉淀甲是
S (填化学式), 生成沉淀甲的离子方程式为 2S2-+SO
(1)沉淀甲是
S (填化学式), 生成沉淀甲的离子方程式为 2S2-+SO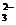 +6H+
+6H+ 3S↓+3H2O
;
(2)沉淀乙是Al(OH)3(填化学式),由溶液甲生成沉淀乙的离子方程式为 Al3++3HCO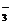
Al(OH)3↓+3CO2↑;
(3)沉淀丙可能是BaCO3或BaCO3和BaSO4 (填化学式)。
(4)气体甲的成分有哪几种可能,答:① H2S ②SO2 ③ ;
(有多少种就填多少种,可不填满。)
(5)综合上述信息,可以肯定存在的离子有S2- SO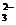 AlO
AlO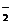 Na+ 。
Na+ 。
6.工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl = CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀; pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3-4时,Fe3+以Fe(OH)3的形式完全沉淀。
⑴ 为除去溶液中Fe2+,可采用的方法是 。
⑵ 工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,溶液的pH变化是 。
⑶ 若此溶液只含Fe3+时,要调整pH在3-4之间,此时最好向溶液中加入 。
⑷ 已知溶液中c(Cu2+)与溶液pH的关系为lg c(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1 mol/L,要保证此溶液中Cu2+刚好不发生Cu(OH)2沉淀,则溶液pH应为___________,此时溶液中的铁离子能否沉淀完全_________(填“能”或“否”)。
5.某无色溶液中存在SiO32-,若向其中加入NH4Cl溶液后产生白色沉淀,若向其中加入CaCl2溶液也产生白色沉淀,则下列各组离子能在该溶液中共存的是
A、F-、C17H35COO-、Na+、NO3- B、AlO2- 、NH4+、ClO-、CO32-
C、CO32-、NH4+、Ag+、MnO4- D、Na2+、Ca2+、C2O42-、Cl-
4.下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是
A.Na+、Ba2+、Cl-、SO42- B.H+、NH4+、Al3+、SO42-
C.H+、Fe2+、NO3-、Cu2+ D.K+、AlO2-、CH3COO-、NO3-
3.下列各组溶液中,不用任何其他试剂就能鉴别的是
A.NaAlO2、KHCO3、NaCl、NaHSO4 B.HCl、NaOH、K2SO4、NaHSO4
C.Na2SO4、H2SO4、AlCl3、BaCl2 D.NaOH、FeCl3、MgCl2、K2SO4
2.下列各组离子在相应的条件下一定能大量共存的是
A.pH=1的溶液中:NO3-、K+、Cl-、Fe2+
B.某无色溶液中:OH-、Mg2+、Na+ 、SO42-
C.pH=13的溶液中:NH4+、Al3+ 、Cl-、K+
D.与铝反应产生氢气的溶液中:Ba2+、Cl-、NO3-、K+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com