
1、凯末尔的出生和学生时代
①出生:1881年,出生在巴尔干半岛萨罗尼加(今希腊境内),生活在奥斯曼帝国封建专制统治之下;
②父亲早逝,但他学业成绩突出;后毕业于伊斯坦布尔的军事学院。
--认清社会现状,萌发了民族意识和变革图强的思想.
3.在大马士革服役期间,组建”祖国与自由协会”,投入到反对封建专制统治的资产阶级革命中.
14.某资料说铁锈的成分为Fe2O3·H2O和FeCO3的混合物。根据此记载,某实验兴趣小组设计下列实验来验证其中是否含有碳酸亚铁。
①取一高度腐蚀的干燥铁钉,称其质量为10.04g,在氮气保护下,充分加热,冷却后称得质量为8.92g。
②将①得到的残渣投入到5.00mol/L的硫酸中,不断添加硫酸直至残渣完全溶解时,恰好用去硫酸31.00mL。整个过程无气体放出。试回答下列问题:
⑴铁锈中是否含有碳酸亚铁?理由是?(有)
⑵锈蚀的铁钉中含Fe2O3·H2O多少克?(8.9g)
⑶锈蚀前铁钉的质量至少多少克? (6.44g)
0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此
回答下列问题:⑴ 甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品的
 质量为 g。
质量为 g。
⑵ 乙取样品②,反应后的溶液中既含有Fe3+,又含有
Fe2+离子,则样品②的质量(设为ag)范围是 。
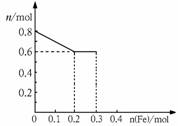
⑶ 丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3-三种离子中的两种离子的物质的量变化曲线如下图所示,则该曲线表示 离子物质的量变化的曲线,请你在此图中再画出另外两种离子的物质的量的变化曲线。
13.有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有
12.一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1 mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
11.已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
① 滴加适量的NaBiO3溶液,溶液变为紫红色。
② 继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③ 再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④ 最后通入足量的SO2气体。请回答下列问题:
⑴ KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________________;
⑵ 实验④中的现象为:_______________;
⑶ 实验②③反应的离子方程式分别是:_________________、_____________________。
10.目潜新一代高效、无污染的消毒剂二氧化氯(ClO2)已经被许多发达国家广泛应用在饮用水的处理上.
⑴ 实验室制备ClO2的方法是用亚氯酸钠与氯气反应:
 □NaClO2+□Cl2□ClO2+□NaCl。
□NaClO2+□Cl2□ClO2+□NaCl。
① 配平上述反应方程式;
② NaClO2、Cl2、ClO2三种物质的氧化性由强到弱的顺序是 ;
⑵ 工业制备ClO2的一种方法是用甲醇在酸性介质中还原氯酸钠。请完成并配平下列反应方程式,并标出电子转移的方向和数目:
 □CH3OH+□NaClO3+□ □ClO2+□CO2+□Na2SO4+□H2O
□CH3OH+□NaClO3+□ □ClO2+□CO2+□Na2SO4+□H2O
⑶ 若上述两个反应中转移等量的电子,则两种方法制得的ClO2的物质的量之比为
n⑴∶n⑵= 。
9.已知下列反应:2HBr+H2SO4(浓)==Br2+ SO2 + 2H2O,Br2+ SO2+ 2H2O==2HBr+H2SO4有关上述反应的结论正确的是
A.上述两个反应是矛盾的
B.氧化性:Br2>H2SO4(浓)>H2SO4(稀)
C.氧化性:H2SO4(浓)>Br2.>H2SO4(稀)
D.物质的氧化性或还原性的强弱与反应条件、浓度等无关
8.有如图装置,下列有关说法正确的是
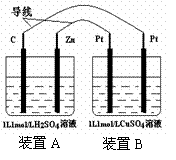 A.当锌棒质量减少6.5g时,和碳棒相连的Pt电极质
A.当锌棒质量减少6.5g时,和碳棒相连的Pt电极质
量增加6.4g
B.同温同压下,当电路中转移1mol 电子时碳棒以及
和碳棒相连的Pt电极上产生的气体体积相等
C.假设两装置中溶液的体积保持不变,则当电路中转
移1mol电子时,装置A中pH增大,装置B中pH为1
D.当电路中转移1mol电子时,装置A中的溶液质量增
加31.5g,装置B中的溶液质量减少40g
6.制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 A.烧杯中有铜无铁 B.烧杯中有铁无铜 C.烧杯中铁、铜都有 D.烧杯中铁、铜都无 7.反应⑴是自海藻灰中提取碘的主要反应,反应⑵是自智利硝石中提取碘的主要反应:
2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2 …………⑴
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 …………⑵
下列有关说法正确的是
A.NaI 和NaIO3在一定条件下能反应生成I2
B.I2在反应⑴中是还原产物,在反应⑵中是氧化产物
C.两个反应中生成等量的I2时转移的电子数相等
D.氧化性:MnO2>IO3->I2>SO42->Mn2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com