
10、联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl.NaCl和NH4Cl共同存在时的溶解度曲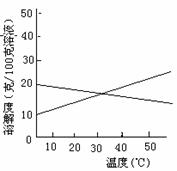
线如图所示,以下操作正确的是
|
|
通入气体 |
温度控制 |
|
(A) (B) (C) (D) |
CO2 CO2 NH3 NH3 |
30~40℃ 0~10 ℃ 30~40 ℃ 0~10℃ |
9、I. 合成氨工业对化学的国防工业具有重要意义。写出氨的两种重要用途 。
II. 实验室制备氨气,下列方法中适宜选用的是 。
① 固态氯化铵加热分解 ② 固体氢氧化钠中滴加浓氨水
③ 氯化铵溶液与氢氧化钠溶液共热 ④ 固态氯化铵与氢氧化钙混合加热
III. 为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
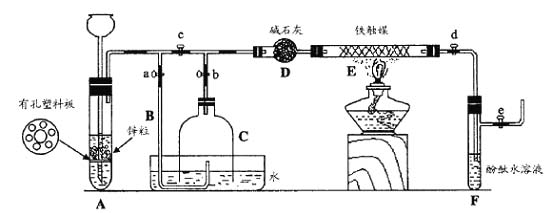
[实验操作]
① 检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
② 关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③ 用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是 ,C瓶内气体的成份是 。
(3)在步骤③中,先加热铁触媒的原因是 。反应管E中发生反应的化学方程式是 。
8、航天飞行器座舱内空气更新过程如图所示:
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式
(2)从装置Ⅰ,Ⅱ,Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28mol O2,呼出23 mol CO2,则宇航员每天呼出的气体中含H2O
mol。
(3)以下是另一种将CO2转化为O2的实验设想
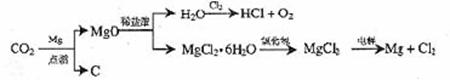 其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
①上图中,装置a由
、
、双孔塞和导管组成
②循环物质甲的名称是
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是
④装置b中填充的物质可能是
(填入编号)
c.硅胶 f.碱石灰 g. 无水氯化钙 h.浓硫酸
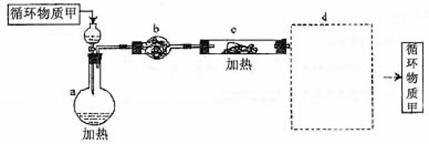
其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
①上图中,装置a由
、
、双孔塞和导管组成
②循环物质甲的名称是
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是
④装置b中填充的物质可能是
(填入编号)
c.硅胶 f.碱石灰 g. 无水氯化钙 h.浓硫酸
⑤设计d装置要注意防止倒吸,请在方框中画出d装置的简图,并要求与装置c的出口处相连(铁架台不必画出)。
7、下图中能验证氯化钠溶液(含酚酞)电解产物的装置是
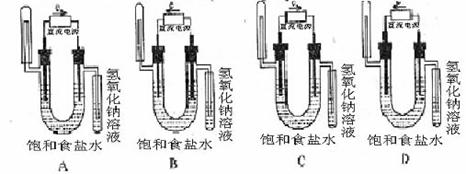
6、根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
|
|
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH4HCO3会有分解 请回答:
(1)反应温度控制在30-35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为 。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(3)过滤所得的母液中含有 (以化学式表示),需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=
5、我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
(1) 上述生产纯碱的方法称 ,副产品的一种用途为 。
(2) 沉淀池中发生的化学反应方程式是 。
(3) 写出上述流程中X物质的分子式 。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a) 增大NH4+的浓度,使NH4Cl更多地析出 (b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
4.工业生产的纯碱常含有少量的NaCl等杂质.图2-3是测定产品中Na2CO3质量分数的实验装置.
操作步骤有: A.在干燥管内填满碱石灰,质量为mg B.取ng样品装入广口瓶中 C.检查装置气密性 D.关闭止水夹 E.打开止水夹 F.缓慢鼓入空气数分钟,再称干燥管质量为Wg G.缓慢加入稀硫酸至不再产生气体为止 H.缓缓鼓入空气数分钟 (1)正确的操作顺序是(填符号):C→________→E→________→D→________→G→________→F (2)步骤F中,要缓缓鼓入空气数分钟,鼓入空气的目的是_________,装置甲的作用是________,装置乙的作用是_______. (3)计算溶液中Na2CO3的质量分数的计算式是________. (4)若去掉装置甲,测定结果会________,若去掉装置乙,测定结果会________.(填“偏大”、“偏小”或“无影响”.)
3、实验室用氨氧化制取NO2气体,可将下图中A,B,C三部分仪器直接相连来实现。
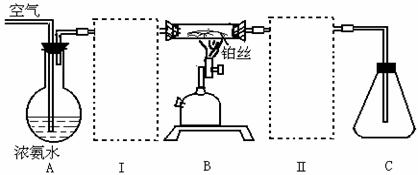 按上述装置制NO2时,在锥形瓶中常常观察到白色烟雾,试在方框I和II中分别出所需仪器,并在仪器中装入适当药品,能使锥形瓶中出现明显的红棕色NO2气体。
(1)在锥形瓶中出现白色烟雾的原因是______________
(2)现代工业生产硝酸,最主要的一个设备是___________制得HNO3的一般浓度为50%,若要制得更浓的HNO3,可用________作吸水剂,再经__________即可得到96%以上的浓HNO3
按上述装置制NO2时,在锥形瓶中常常观察到白色烟雾,试在方框I和II中分别出所需仪器,并在仪器中装入适当药品,能使锥形瓶中出现明显的红棕色NO2气体。
(1)在锥形瓶中出现白色烟雾的原因是______________
(2)现代工业生产硝酸,最主要的一个设备是___________制得HNO3的一般浓度为50%,若要制得更浓的HNO3,可用________作吸水剂,再经__________即可得到96%以上的浓HNO3
2、合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
(1)1m3(标准状况)CH4按上式完全反应,产生H2 mol。
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。1m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为 。
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如下表:
|
气体 |
CO |
H2 |
N2 |
O2 |
|
体积(L) |
25 |
60 |
15 |
2.5 |
计算该富氧空气中O2和N2的体积比V(O2)/V(N2)。
(4)若CH4和H2O(g)及富氧空气混合反应的产物中,V(H2)/V(N2)=3︰1 (合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为何值?
在合成氨时,将1体积氮气和3体积氢气混合后通过合成塔中催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2和H2的体积分数各为多少?
1、利用天然气合成氨的工艺流程示意如下:
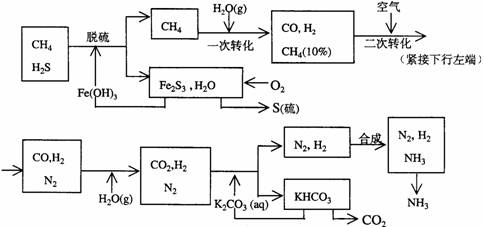
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于 (写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com