
2.关于互成角度的两个初速度不为零的匀变速直线运动的合运动,下列说法正确的是:( )
A.合运动的轨迹一定是抛物线 B.合运动的性质一定是匀变速运动
C.合运动的轨迹可能是直线,也可能是曲线 D.合运动的性质无法确定
1.如图所示,分别是物体运动的位移x、速度v、加速度a和物体受到的合外力F随时间t的变化图象,其中表示物体在做匀加速运动的是 ( )

20.(15分)超音速飞机在平流层飞行时,尾气中的 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的 和
和 转变成
转变成 和
和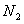 ,化学方程式如下:
,化学方程式如下:

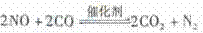
 为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:


 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
 (1)写出该反应的平衡常数表达式K=
。
(1)写出该反应的平衡常数表达式K=
。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)在上述条件下反应能够自发进行,则反应的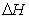 0(填写“>”、“<”、“=”)。
0(填写“>”、“<”、“=”)。
 (4)
(4) 假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
。
假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
。
 A.选用更有效的催化剂
B.升高反应体系的温度
A.选用更有效的催化剂
B.升高反应体系的温度
 C.降低反应体系的温度
D.缩小容器的体积
C.降低反应体系的温度
D.缩小容器的体积
 (5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。

①请在上表格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线示意图,并标明各条曲线的实验编号。

19.(16分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸 附气体的能力强,性质稳定,请回答:
附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)正极反应式为 。
(3)电极表面镀铂粉的原因为
 。
。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全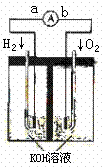 储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2
储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2
 2LiH
2LiH  Ⅱ.LiH+H2O=LiOH+H2↑
Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
 ②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
 ③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
mol。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
mol。
18.(8分)痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
① HUr(尿酸,aq)  Ur-(尿酸根,aq)+H+(aq)
(37℃时,Ka =4.0×10-6)
Ur-(尿酸根,aq)+H+(aq)
(37℃时,Ka =4.0×10-6)
②NaUr(s)  Ur-(aq)+Na+(aq)
Ur-(aq)+Na+(aq)
(1)37℃时,1.0L水中可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为 。
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp (填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是 (填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol/L,其中尿酸分子的浓度为5.0×10-4mol/L,该病人尿液的c(H+)为 。
17.(6分)
 通过下列两步实验测定草酸晶体(H 2C2O4·xH2O)中结晶水x的值:
(1)称取2.52 g草酸晶体,配制成100 .00 mL溶液。
通过下列两步实验测定草酸晶体(H 2C2O4·xH2O)中结晶水x的值:
(1)称取2.52 g草酸晶体,配制成100 .00 mL溶液。
(2)取25.00 mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为0.100 mol·L-1 KMnO4溶液进行滴定。
其反应原理是:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O 请回答下列问题:
①实验(2)中,KMnO4应装在 滴定管中(填“酸式”、“碱式”),判断达到滴定终点的现象是 ;
②若滴定终点时,共用去KMnO4溶液20.00 mL,则x = (用含有m、V的代数式表示)。
16.(10分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:① X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的电子式是 。
(2)Z2Y2与X2Y反应的化学方程式是 。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
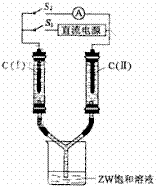 C(I)的电极名称是
(填写正极或负极);
C(I)的电极名称是
(填写正极或负极);
其电极反应式是

 。
。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是 。
15.一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g)
△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K可自由移动)。下列说法正确的是
2C(g)+D(g)
△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K可自由移动)。下列说法正确的是
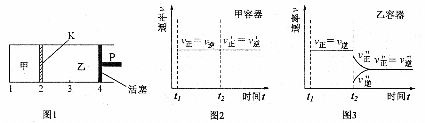
A.保持温度和活塞P位置不变,在甲中再加入1 molA和2molB,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞P位置不变,升高温度,达到新的平衡后,K会向右移动
C.保持温度和K位置不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后, 乙
乙 中C的体积分数小于甲中C的体积分数
中C的体积分数小于甲中C的体积分数
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
第二卷(非选择题,共55分)
14.关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
H4+):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH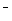 )+c(NH3·H2O)
)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH4+)>c(Cl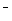 )>c(OH
)>c(OH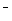 )>c(H+)
)>c(H+)
13.已知:25°C时,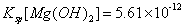 ,
, 。下列说法正确的是
。下列说法正确的是
A.25°C时,在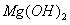 的悬浊液中加入少量的
的悬浊液中加入少量的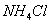 固体,
固体,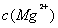 增大
增大
B.25°C时,饱和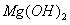 溶液与饱和
溶液与饱和 溶液相比,前者的
溶液相比,前者的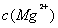 大
大
C.25°C时,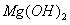 固体在20mL 0.01 mol·
固体在20mL 0.01 mol· 氨水中的
氨水中的 比在20mL0.01mol·
比在20mL0.01mol·
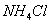 溶液中的
溶液中的 小
小
D.25°C时,在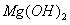 的悬浊液加入NaF溶液后,
的悬浊液加入NaF溶液后,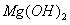 不可能转化成为
不可能转化成为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com