
3.分析事例:在中和滴定操作过程中,对于以下各项因操作不当引起的实验误
差,用“偏高”“偏低”或“无影响”等填空:
⑴滴定管用蒸馏水洗净后,未用标准溶液润洗,使滴定结果_ _。
⑵锥形瓶用蒸馏水洗净后,又用待测溶液润洗,使滴定结果___ ______。
⑶标准液滴定管在滴定前尖嘴处有气泡,滴定终了无气泡,结果_______。
⑷滴定前平视,滴定终了俯视,使滴定结果___________。
⑸滴定前仰视,滴定终了平视,使滴定结果____________。
⑹过早估计终点,使滴定结果_______________。
⑺过晚估计终点,使滴定结果_______________,
⑻用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度___________。
⑼用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度___________。
(10)洗涤锥形瓶时,误把稀食盐水当做蒸馏水,然后用锥形瓶装待测的盐酸,用NaOH标准溶液滴定时,对测得的结果______________。
[例题解析]
[例1] 用0.1mol/LNaOH溶液滴定100ml 0.1mol/L盐酸时,如果滴定误差在±0.1%以内,反应完毕后,溶液的pH范围为( )
A.6.9-7.1 B.3.3-10.7 C.4.3-9.7 D.6-8
解题思路: 。
易错点: 。
[例2] 用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可
先在混合液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后
用标准盐酸滴定(用酚酞作指示剂).试回答:
(1)滴定时BaCO3能否溶解?理由是
(2)如用甲基橙做指示剂,则测定的结果
解题思路: 。
易错点: 。
[考题再现]
2.分析原理:据c标·V标·n标=c待·V待·n待有n待= 。
1. 产生误差的因素:(1)标准溶液不标准、⑵仪器洗涤未按要求、⑶滴定管气泡未排尽、⑷滴定管读数方法不正确、⑸滴定管漏液、⑹终点判断不准、⑺滴定操作过程和读数过快等
2.滴定:⑴用 移取一定体积的 到 中,加 ,在瓶底垫 ;
⑵滴定时左手 、右手 、目光注视 。
⑶终点判断:① 、② 、③ 、④ 。
⑷读数:注意: 。
⑸重复滴定:①目的 、
②当第二次读数与第一次读数误差很小时,是否需要进行第三次滴定 ,当第二次读数与第一次读数误差较大时,应该 直到 为止,此时应该取 作为计算标准。
1.准备:⑴ 、⑵ 、
⑶ 、⑷ 、
⑸ 、⑹ 。
3.试剂:⑴ 、 、 。
⑵指示剂的选择原则: 。
2.仪器:
⑴酸式滴定管:①构造特点: 、
②洗涤要求: 、
③不能盛放的溶液: 。
⑵碱式滴定管:①构造特点: 、
②洗涤要求: 、
③不能盛放的溶液: 。
⑶锥形瓶洗涤要求: 。
⑷其它用到的仪器: 。
1.酸碱中和滴定:
⑴概念: 。
(2)原理: 。
⑶关键:①准确测定 ;
②准确判断 。
18.⑴– lg 0.11
⑵H2SO4的第一级电离抑制了HSO4-的电离
⑶大于
⑷能。因为生成的氯化氢气体可以不断脱离反应体系
⑸在这两种物质中,Cu2+ 都能水解使溶液呈酸性,而在CuSO4 溶液中,SO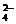 能水解一部分产生OH-,从而使Cu2+ 水解产生的酸性有一部分被抵消,而ClO
能水解一部分产生OH-,从而使Cu2+ 水解产生的酸性有一部分被抵消,而ClO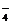 不会发生水解
不会发生水解
17.SO2溶解于雨水中一部分开始即被氧化为硫酸,一部分仍以亚硫酸存在,雨水降下后在与空气充分接触的过程中,弱酸--亚硫酸还会被氧化为强酸--硫酸,所以PH值会变小。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com