
2.[解析] 题目给出两个重要条件:pH=1(即酸性)和无色透明,并要求找出不能共存的离子组。选项A中Ag+与Cl-不能共存,生成的AgCl不溶于HNO3(H+和NO3-),Al3+、NO3-、H+都为无色,符合题意。选项B、D中的各离子虽都是无色的,但能共存于酸性溶液中,不符合题意。选项C中各离子能够共存,且为无色,但S2-与H+不能大量共存,所以C也符合题意。
[答案]AC
[考题再现] 1. C 2. B 3.B
[针对训练]
1.[解析] 此题实质上是0.05mol/L的HAc溶液和0.05mol/L的NaAc溶液的混合溶液。由电荷守恒关系可得:
c(H+)+c(Na+)=c(Ac-)+c(OH-) (1)
由物料守恒关系可得:
c(HAc)+c(Ac-)=c(Na+)×2=0.01mol/L (2)
由(2)可知D正确。等浓度的HAc和NaAc的混合溶液显酸性,可知A正确
将(1)×2+(2)可得:
2c(H+)=c(Ac-)+2c(OH-)-c(HAC)(3)
C选项错误。
[答案]AD
21.工业上制备BaCl2的工艺流程图如下:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s)
△H1 =
571.2 kJ·mol-1 ①
4CO(g) + BaS(s)
△H1 =
571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2=
226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=
226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,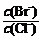 =
。
=
。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g) 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是
, 。
第三课时 盐类的水解
[例题解析]
20.北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC
 CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH3CH
 CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC
 CH(g ) △H2=32.4 kJ·mol-1
CH(g ) △H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH
 CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
⑷常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
19.一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是
A.c(A-)≥c(M+) B. c(A-)≤c(M+)
C.若MA不水解,则c(OH-)<c(A-) D.若MA水解,则c(OH-)>c(A-)
D.奥赛一瞥
18.将0.2mol/LCH3COOK与0.1 mol/L盐酸等体积混合后,溶液中下列微粒的物质的量浓度关系正确的是
A.c(CH3COO-) = c(Cl-) = c(H+)>c( CH3COOH)
B.c(CH3COO-) = c(Cl-) >c( CH3COOH) >c(H+)
C.c(CH3COO-)>c(Cl-)>c(H+)>c( CH3COOH)
D.c(CH3COO-)>c(Cl-)>c( CH3COOH) >c(H+)
17.等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度应满足的关系是
A.c(M+)>c(OH-)>c(A-)>c(H+) B.c(M+)>c(A-)>c(H+)>c(OH-)
C.c(M+)>c(A-)>c(OH-)>c(H+) D.c(M+)>c(H+) =c(OH-) + c(A-)
16.设氨水的pH=x,某盐酸的pH=y,已知x + y=14,且x>11。将上述两溶液分别取等体积充分混合后,所得溶液中各离子浓度由大到小的顺序是
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.c(NH4+)>c(Cl-)>c(OH-)>c(H+) D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
15.向含有Mg2+、Fe2+、Al3+、NH4+四种离子的溶液中加入过量的NaOH溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是 。
C.能力训练
14.(1)加热AlCl3·6H2O,最后所得固体成分为 ,要想得到无水AlCl3,应该采取的措施是
(2)为了防止FeSO4溶液变质,在配制时应该采取的措施是:
(3)用SiCl4和浓氨水可以隐蔽海上的军事目标,请用化学方程式和简单的语言解释如下:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com