
4、如图所示是一种汽车安全带控制装置的示意图.当汽车处于静止或匀速直线运动时,摆锤竖直悬挂,锁棒水平,棘轮可以自由转动,安全带能被拉动.当汽车突然刹车时,摆锤由于惯性绕轴摆动,使得锁棒锁定棘轮的转动,安全带不能被拉动.若摆锤从图中实线位置摆到虚线位置,汽车的可能运动方向和运动状态是:
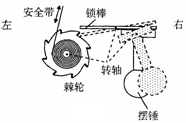 A.向右行驶、突然刹车
A.向右行驶、突然刹车
B.向左行驶、突然刹车
C.向左行驶、匀速直线运动
D.向右行驶、匀速直线运动
3、在地质、地震、勘探、气象和地球物理等领域的研究中,需要精确的重力加速度g值,g值可由实验精确测定。近年来测g值的一种方法叫“对称自由下落法”,它是将测g归于测长度和时间,以稳定的氦氖激光波长为长度标准,用光学干涉的方法测距离,以铷原子钟或其他手段测时间,能将g值测得很准,具体做法是:将真空长直管沿竖直方向放置,自其中O点向上抛小球又落至原处的时间为T2,在小球运动过程中经过比O点高H的P点,小球离开P点至又回到P点所用的时间为T1,测得T1 、T2和H,可求得g等于:
A. B.
B. C.
C. D.
D.
2、 如图所示,有些地区的铁路由于弯多、弯急,路况复杂,依靠现有车型提速的难度较大,铁路部门通过引进摆式列车来解决转弯半径过小造成的离心问题,摆式列车是集电脑、自动控制等高新技术于一体的新型高速列车。当列车转弯时,在电脑控制下,车厢会自动倾斜,使得车厢受到的弹力FN与车厢底板垂直,FN与车厢重力的合力恰好等于向心力,车厢没有离心侧翻的趋势(车轮内缘还要受到外轨侧向的弹力),当列车行走在直线上时,车厢又恢复原状,就像玩具“不倒翁”一样。它的优点是能够在现有线路上运行,无需对线路等设施进行较大的改造。运行实践表明:摆式列车通过弯道的速度可提高20%---40%,最高可达50%,摆式列车不愧为“曲线冲刺能手”。假设有一超高速摆式列车在水平面内行驶,以360Km/h的速度转弯,转弯半径为2 Km,则质量为50Kg 的乘客在拐弯过程中所受到的火车给他的作用力约为:
如图所示,有些地区的铁路由于弯多、弯急,路况复杂,依靠现有车型提速的难度较大,铁路部门通过引进摆式列车来解决转弯半径过小造成的离心问题,摆式列车是集电脑、自动控制等高新技术于一体的新型高速列车。当列车转弯时,在电脑控制下,车厢会自动倾斜,使得车厢受到的弹力FN与车厢底板垂直,FN与车厢重力的合力恰好等于向心力,车厢没有离心侧翻的趋势(车轮内缘还要受到外轨侧向的弹力),当列车行走在直线上时,车厢又恢复原状,就像玩具“不倒翁”一样。它的优点是能够在现有线路上运行,无需对线路等设施进行较大的改造。运行实践表明:摆式列车通过弯道的速度可提高20%---40%,最高可达50%,摆式列车不愧为“曲线冲刺能手”。假设有一超高速摆式列车在水平面内行驶,以360Km/h的速度转弯,转弯半径为2 Km,则质量为50Kg 的乘客在拐弯过程中所受到的火车给他的作用力约为:
A. 500N B.559N C. 707N D. 0
孝感三中防伪标记
1、绳系卫星是由一根绳索栓在一个航天器上的卫星,可以在这个航天器的下方或上方随航天器一起绕地球运行。如图所示,绳系卫星系在航天器上方,当它们一起在赤道上空绕地球作匀速圆周运动时(绳长不可忽略)。下列说法正确的是:
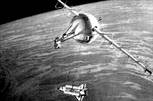 A.绳系卫星在航天器的前上方
A.绳系卫星在航天器的前上方
B.绳系卫星在航天器的后上方
C.绳系卫星的加速度比航天器的小
D.绳系卫星的加速度比航天器的大
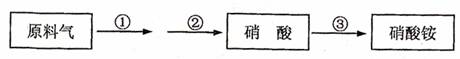 21.某化肥厂生产硝酸铵过程如下:
21.某化肥厂生产硝酸铵过程如下:
其中反应②为:4NO+3O2+2H2O===4HNO3原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
(1)写出反应①的化学方程式 。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中制备硝酸的氨气(不包含第③步被硝酸吸收的氨气)的体积分数最大值为 。
(3)若实际生产中,反应①中氨的转化率(或利用率)为a,反应②中NO的转化率为b,反应③中氨的转化率为c,硝酸完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为多少?在合成硝酸铵的全流程中,氨气的总利用率为多少?
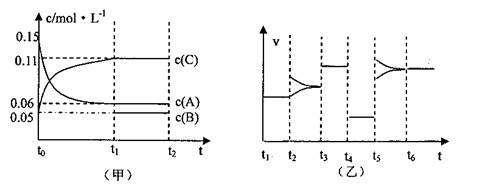 20.向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3-t4阶段为使用催化剂。
20.向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3-t4阶段为使用催化剂。
(1)若t1=15s,则t0-t1阶段以C浓度变化表示的反应速率v(C)为= 。
(2)若t2-t3阶段,C的体积分数变小,此阶段v(正) v(逆)(填“>”“<”“=”)
(3)t4-t5阶段改变的条件为 ,B的起始物质量为 。
(4)t5-t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式 。
19.下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质。O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品(图中部分反应物和生成物没有列出)。
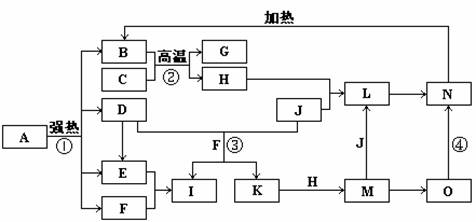
请按要求回答:
(1)H元素在周期表中的位置 。
(2)写出L的化学式 ;
(3)反应③的离子方程式 ;
反应④的化学方程式 ;
(4)反应②在工业生产上的用途是 ;
(5)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1∶1∶1∶14,则反应①的化学方程式为 。
18.I 实验室中打开盛有浓盐酸的试剂瓶,瓶口立即产生大量的白雾;把盛有浓氨水的试剂瓶打开,在瓶口却看不到白雾。对此,甲、乙、丙三位同学分别提出如下假设:
甲:NH3与水蒸气的结台能力不如HCl强,瓶口附近形成的氨水小液滴少,达不到肉眼可见的程度。
乙:浓氨水的挥发性不如浓盐酸强.瓶口附近空气中的NH3少.形成的氨水小液滴少.
产生的白雾达不到能被肉眼观察的程度。
丙:NH3的相对分子质量比HCl小,NH3的扩散速率比HCl快,由于挥发出的NH3快速地向四周扩散,形成的氨水小液滴不易集中.所以看不到白雾。
为了验证假设的上的正确性,三位同学在老师的指导下进行了下列实验:
如下图所示-取-根长50cm直径约2cm的玻璃管,水平放置在其两端分别同时塞入蘸有浓盐酸与浓氨水的棉球,立即用橡皮塞塞紧两端。数分钟后,玻璃管中在距离浓盐酸一端约18cm处开始产生白烟。

(1)在进行上述实验之前,甲同学就发现自己假设中的错误,确定甲假设中错误的理由是: 。
(2)上述实验中白烟产生在离浓盐酸一端约18cm处的事实.说明 。所以,关于浓氨水试剂瓶口看不到白雾的原因 的假设是正确的。
Ⅱ 氯化铵除了用作为肥料以外,也用在金属的焊接上,以除去金属表面的氧化物薄层。最近,我国又有学者将氯化铵用于制备无水氯化镁,其流程为:
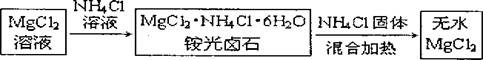
氯化铵的这两项用途也与上述实验中所观察到的现象密切相关。试同答下列问题:
(3)氯化铵的电子式为: 。
(4)在加热条什卜氯化铵能除去金属表面氧化物的原因:
(5)在制备无水氯化镁的过程中如果不添加一定量的氯化铵可能造成的结果:
16.BaCl2溶液中通入SO2气体无沉淀产生,若同时将另一种气体A通入BaCl2溶液中,产生白色沉淀,则A可能为 、 (要求填一种化合物和一种单质的化学式)。写出其中化合物A与上述溶液反应的化学反应方程式 。
 四、本题包括2小题,第17题共13分,第18题共10分。
四、本题包括2小题,第17题共13分,第18题共10分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com