
18.Ⅰ. 淡绿色;大(每空2分,共13分)
Ⅱ. KSCN; Cl2 +2 Fe2+ == 2Cl- + 2Fe3+、Fe3+ + 3SCN- == Fe (SCN)3(每空1分,共6分)
Ⅲ. 8 NH4+ + 4 Fe2+ + 16 OH- +
O2  4 Fe (OH)3↓+ 8 NH3↑
+ 6 H2O (3分)
4 Fe (OH)3↓+ 8 NH3↑
+ 6 H2O (3分)
17.(1)Cu2+ (2)Cl-、 Ag++Cl-==AgCl↓ (3)Mg2+ (4)B
16.(1)a、b、c (2)B (3)9.5g
20.下图为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去,已知乙醇的沸点为78.5℃),请根据要求完成下列问题(仪器装置可任意选用,必要时可重复选择,a、b为旋钮)。

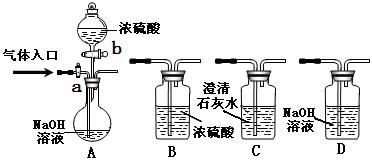
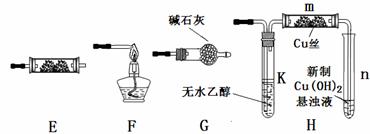
(1)若A中气体入口通入CO和CO2的混合气体,E内放置CuO,欲得到纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为________ ___ (填写装置代号)。能验证CO氧化产物的实验现象是
___________________ ____。
(2)完成(1)实验后,将A中a旋钮关闭,并在E内放置Na2O2,按A→E→D→B→H装置顺序,制取纯净干燥的O2,并用O2氧化乙醇。
①为获得氧气,关闭a旋钮后,首先需进行的操作是 。
②为得到平稳的乙醇蒸气流,提高反应效率,可采取的措施是(用文字简述或在原装制图的相应位置画出简图)__
___;m中发生反应的化学方程式是___________________ ____
③若想观察到试管n中有红色沉淀出现,还需要进行的操作是_____ __________。
[答案]
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
A |
D |
A |
B |
B |
C |
C |
C |
C |
D |
C |
A |
D |
D |
D |
19.(莱阳一中2008 - 2009学年度第一学期学段检测)某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案。
[方案一]气体分析法
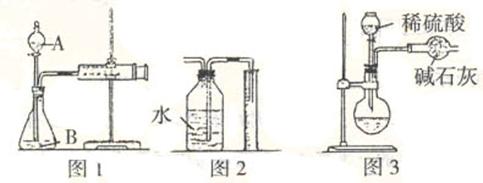
(1)甲同学用图1所示装置,把xg的混合物与足量稀硫酸反应后,测定产生的C02气体的体积。实验开始时检查该装置气密性的方法是
。
(2)乙同学用图2代替图1中的收集装置,则所测CO2气体的体积 (填“偏大”、“偏小”、“不变”),你的改进方案是 。
(3)丙同学用图3装置测定CO2的质量,该装置存在较多缺陷,从而导致实验误差,请你填写其中的三点缺陷:I ;
Ⅱ ;
Ⅲ 。
[方案二]沉淀分析法(如图所示)。

(4)操作1的名称是 ;操作2的名称是 。在进行操作1之前,应判断是否沉淀完全,判断的方法是
。
(5)根据沉淀分析法,该固体混合物中Na2CO3质量分数的计算式为 。
18. (北京市朝阳区高三年级统一考试)硫酸亚铁铵俗称莫尔盐,用途极广。某同学为了验证硫酸亚铁铵晶体中的阳离子,进行了如下操作,请完成相关填空。
Ⅰ. 室温下,将少量的硫酸亚铁铵晶体配成溶液,溶液颜色为 色,此时该溶液与
同物质的量浓度的硫酸铵溶液相比, c(NH4+) (填“相等”、或“大”、或“小”)。
Ⅱ. 将所配溶液分别置于两支试管中,用其中一支进行验证Fe2+的实验,具体操作及现
象和原因如下:
|
操作 |
① 往试管中滴入几滴 溶液(填化学式) |
② 继续滴入几滴新制氯水 |
|
现象 |
溶液不变红色
|
溶液变红色 |
|
原因 |
溶液中没有Fe3+ |
(用离子方程式表示) |
Ⅲ.为了验证NH4+,往另一支试管中滴加过量的浓氢氧化钠溶液并加热,并在试管口用
湿润的红色石蕊试纸检验,红色石蕊试纸变蓝,证明有NH4+离子,同时,还看到试管内有红褐色固体产生,写出该反应的离子方程式
。
17.(安徽师大附中2008-2009学年度第一学期期中考试高三化学)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是_________。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子是___________,有关的离子反应式为
______________。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有_______________。
(4)原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_________。
A.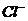 B.
B. C.
C.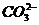 D.
D.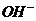
16.(芜湖一中2008届高三第二次模拟考试)下面a-e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)其中标示出仪器使用温度的是 (填写编号)
(2)由于操作错误,使得到的数据比正确数据偏小的是 (填写编号)
A.实验室制乙烯测量混合液温度时,温度计的水银球与烧瓶底部接触
B.中和滴定达终点时俯视滴定管内液面读数
C.使用容量瓶配制溶液时,俯视液面定容所得溶液的浓度
(3)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 g。
15.按要求设计实验,证明盐类水解是吸热的,下列回答正确的是
A. 将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B. 在盐酸中加入相同浓度的氨水,若混合液温度下降,说明盐类水解是吸热的
C. 在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明醋酸钠水解是吸热的
D. 在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明醋酸钠水解是吸热的
14.已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6mol/L NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片用水冲洗、烘干后称量,得质量为m2。下列说法正确的是 ( )
A.设锌镀层厚度为 ,锌的密度为
,锌的密度为 ,则
,则
B.锌电极上发生还原反应
C.锌和石墨形成原电池,外电路中电流从锌流向石墨
D.当石墨不再产生气泡时,应立即取出铁皮
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com