
5.宋代《宣和画谱》称赞顾恺之“天才杰出,独立无偶,妙造精微”。顾恺之绘画艺术的特点是
A.虽不备该形似,而妙有气韵 B.布局严密、线条流畅,人物栩栩如生
C.骨气奇伟,规模宏远 D.善画塔庙,超越群工
4.司马迁为了“究天人之际,通古今之变,成一家之言”,寻访过很多古迹。他能见到的有
A.赤壁古战场 B.四川的都江堰 C.内蒙古的昭君墓 D.河南的白马寺
3.据史料记载,两汉时期,作为南北两条丝绸之路的交汇点,“楼兰曾有积粟百万、威服外国的壮举,曾有狭制丝路、左右西域的辉煌,然而人类活动的加剧以及水系的变化和战争的破坏,使原本脆弱的生态环境进一步恶化,最终导致楼兰地区由绿洲变成了荒漠。”导致楼兰文明衰落的原因有
①人类活动加剧,破坏生态环境 ②经济重心转移
③民族之间战争的破坏 ④两汉中央政府的移民政策
A.①② B.③④ C.①③ D.②④
2.秦以前,民皆以金玉为印,龙虎为钮,唯其所好。秦以来,天子独以印称玺,又独以玉,群臣莫敢用。”(《史记集解》)材料反应了
A.秦朝时期人们以金玉为印 B.皇权至上,皇帝独尊
C.秦以前玉玺为皇帝独有 D.皇权为民,与民共享
1.《吕氏春秋·上农》:“民舍本而事末则其产约(财产轻便),其产约则轻(容易)迁徙,轻迁徙则国家有患,皆有远志,无有居心。”……这段话的核心思想是
A.民贵君轻 B.重农抑商 C.施行仁政 D.实行法制
25、(14分)已知反应:
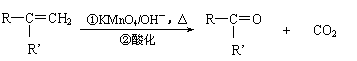

(R、R’可表示烃基或官能团)
A可进行如下反应(方框内物质均为有机物,部分无机产物已略去)。
|
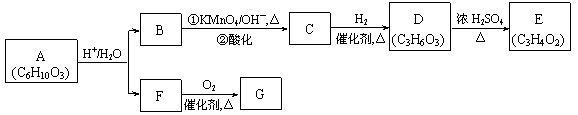

请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量金属钠作用产生H2 22.4 L(标准状况),则F的分子式是 ,名称是 。
(2)G与F的相对分子质量之差为4,则G具有的性质是 (填序号)
a.可与银氨溶液反应
b.可与乙酸发生酯化反应
c.可与氢气发生加成反应
d.1 mol G最多可与2 mol 新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,又知两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是:
,该反应类型是 反应。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:
、 。
(5)A转化为B和F的化学方程式是:
。
昆一中2010届高三年级第三次月考(11月)
23、(14分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O
NH4HCO3 NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
 2NaHCO3 Na2CO3+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某课外活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 ,该试剂的作用是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
;
(3)请你再设计出一种实验室制取少量碳酸氢钠的方法:(用文字简要说明)
。
22、(12分)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。

(1)写出A在加热条件下与H2反应的化学方程式
____________________________________________________________
(2)写出E与A的氢化物反应生成A的化学方程式___________________________
(3)写出一个由D生成B的化学方程式____________________________________;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式__________________________________________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
21、(10分)A、B、C、D、E是原子序数小于18的五种元素,且原子序数依次增大,其中A与B原子的最外层电子数相同,B、C、D、E位于同一周期,D原子的最外层电子数与电子层数相同,E- 与Ar原子的核外电子排布相同。
(1)E显+1价含氧酸的化学式为 。
(2)B的最高价氧化物的水化物与D的最高价氧化物的水化物相互反应的化学方程式为
。
(3)在常温下,D与E形成的化合物的水溶液 ,原因是
(用离子方程式表示)。
,原因是
(用离子方程式表示)。
(4)常温常压下,  的单质在E的单质中完全燃烧,生成共价化合物,并放出
的单质在E的单质中完全燃烧,生成共价化合物,并放出 的热量,该反应的热化学方程式为
。
的热量,该反应的热化学方程式为
。
(5)将C与E组成的化合物溶于水配成溶液,用惰性电极进行电解,阴极的还原产物与阳极的氧化产物的物质的量之比为 。
20、pH=1的两种一元酸HX与HY溶液,分别取50mL加入足量的镁粉,充分反应后,收集到H2体积分别为V(HX)和V(HY)。若V(HX)>V(HY),则下列说法正确的是( )
A、HX可能是强酸
B、HX的酸性比HY的酸性弱
C、两酸的浓度大小c(HX)<c(HY)
D、将两种一元酸均稀释100倍,稀释后两溶液的pH均为3
第二卷:非选择题(共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com