
2、化学共性:
⑴均具有较强的还原性:
⑵在化合物中只有正价没有负价。
1、物理共性:由于金属一般都是以金属键形成金属晶体,实现层状紧密堆积,使金属具有许多共同的性质。
⑴ 状态:通常情况下,除Hg外,其余金属都是固态。
⑵有金属光泽,不透明。
⑶有导热性和导电性。
⑷有延展性。
4、按其丰度不同
按含量 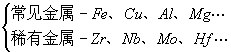
3、按密度不同
按密度 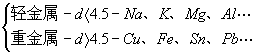
2、冶金工业上:
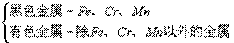
1、按原子结构特点分
⑴无变价金属:ⅠA、ⅡA及Al等金属;
⑵变价金属:ⅣA、ⅤA族、副族、第Ⅷ族金属元素。
3、晶体结构
(1)金属元素形成的金属单质,在固态时全是金属晶体。
在金属晶体中,金属原子好像硬球,一层一层地紧密堆积着。即一个挨一个地堆积在一起,使一定体积的晶体内有最多数目的原子。但由于金属原子的价电子较少,容易失去电子成为金属离子,而释出的价电子并不专 属于某个特定的金属离子,它们在整个晶体里自由地运动着,称为自由电子。金属晶体就是依靠金属阳离子和自由电子间的较强作用形成的。
(2)金属晶体熔沸点与金属键的强弱有关,金属键的强弱与 和 有关;随着 增强,金属键依次增强,金属晶体的熔沸点依次 。
2、原子结构特征
⑴金属元素原子最外层电子数比同周期非金属元素原子最外层电子数少,一般小于4(Sn、Pb、Sb、Bi≥4)。
⑵金属元素原子半径比同周期非金属元素原子半径大(惰性元素除外)。
1、金属元素在周期表中的位置
在目前已知的112种元素中,金属元素有90种,集中位于周期表的左、中下方,属于主族元素和过渡元素。请你自己画出一个元素周期表,并标出金属元素所处的区域。
15.(1)Mg3N2 + 6H2O = 2NH3 + Mg (OH)2
(2)17%
提示:设原混合物中Mg3N2的质量为x,由Mg3N2生成的MgO的质量为y
Mg3N2 → 3MgO
100 120
x y
y
= 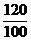 x (0.470-x) +
x (0.470-x) + 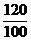 x = 0.486
x = 0.486
x = 0.080 (g)
Mg3N2%
= 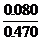 ×100% = 17%
×100% = 17%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com