
1.(1)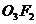 ,体积之比等于物质的量之比以及质量守恒定律
,体积之比等于物质的量之比以及质量守恒定律
(2) 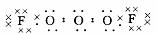 , F-O-O-O-F
, F-O-O-O-F
2.[解析]AB2型离子化合物中,三个电子层结构完全相同的阴阳离子的电子总数是54,说明每个离子电子数是18,则AB2只能为CaCl2,再知道Z有漂白作用,则全题迎刃而解。
[答案](1)CaCl2 Ca(OH)2 Ca(ClO)2
(2)Ca∶+2
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
[考题再现]
1.[解析]10电子微粒和18电子微粒是经常考查的题型,其思维方法是首先确定10电子和18电子的中性原子Ne和Ar,然后找出比它们多或少电子的原子转化成阴阳离子或氢化物分子,另外,18电子微粒可由两个9电子微粒合并而得是一个重要的方法。
[答案](1)K+、Ca2、PH4+ (2)Cl-、S2-、O22-
(3)SiH4 PH3 H2S HCl C2H6 N2H4 H2O2 CH3OH CH3F CH3NH2
NH2OH NH2F 等等 (4)Ar F2
21.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或折开)1mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P-P198kJ·mol-1、P-O360kJ·mol-1、氧气分子内氧原子间的键能为498kJ·mol-1。则P4+3O2=P4O6的反应热△H为
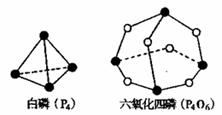
A.+1638kJ·mol-1 B.-1638kJ·mol-1
C.-126kJ·mol-1 D.+126kJ·mol-1
第三课时 化学键
[例题解析]
20.设X、Y、Z代表3种元素,已知:
①X+和Y-两种离子具有相同的电子层结构;
②Z元素原子核内质子数比Y元素原子核内质子数少9个;
 ③Y和Z两元素可以形成四核42个电子的负一价阴离子。
③Y和Z两元素可以形成四核42个电子的负一价阴离子。
据此,请填空:
(1)Y元素是________________,Z元素是_______________。
(2)由X、Y、Z三元素所形成的含68个电子的盐类化合物的分子式(即化学式)是___________________________________________________________。
D.奥赛一瞥
19.已知下列元素的原子半径:

根据以上数据,磷原子的半径(单位:nm)可能的范围是_______________。
18.氮化钠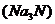 是科学家制备的一种重要的化合物,它与水反应可生成
是科学家制备的一种重要的化合物,它与水反应可生成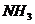 。请回答下列问题:
。请回答下列问题:
(1) 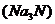 的电子式是_____________,该化合物中含有的化学键为_________________。
的电子式是_____________,该化合物中含有的化学键为_________________。
(2)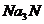 与盐酸反应生成______种盐,其电子式是_______________。
与盐酸反应生成______种盐,其电子式是_______________。
(3)比较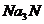 中两种微粒的半径:
中两种微粒的半径: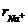 _______
_______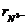 (填“>”、“=”、“<”)。
(填“>”、“=”、“<”)。
17.推断下列微粒的名称,并用电子式表示其形成过程
(1)离子化合物AB,阳离子比阴离子少一个电子层,1 mol AB 中含有12mol电子,则该化合物名称为___________。其形成过程为______________。
(2)由第三周期元素的半径最大的阳离子和半径最小的阴离子形成的化合物___________,名称为___________,形成过程为____________。
16.下列分子中所有原子都满足最外层8电子结构的是 ( )
A.光气(COCl2) B.六氟化硫 C.二氟化氙 D.三氟化硼
15.下面几种离子化合物中,离子键极性最强的是 ( )
A.KCl B.NaCl C.AlCl3 D.Na2S
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com