
19.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学论断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象( )
A. 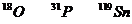
B. 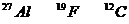
C. 元素周期表中VA族所有元素的原子
D. 元素周期表中第1周期所有元素的原子
第四课时 非极性分子和极性分子
[例题解析]
18.某元素A能形成气态氢化物HxA,它的水溶液能和CaCO3反应放出使澄清石灰水变浑浊的气体,反应中HxA和CaCO3的物质的量之比为2∶1,测得HxA气体在标准状况下的密度为1.629g/L。试确定:
(1)x值;
(2)A的相对原子质量和名称;
(3)H-A键是否是极性键?HxA是否是极性分子?
D.奥赛一瞥
17.已知某元素R的最高价氧化物的水化物0.49g与R的气态氢化物0.17g,分别能和100ml,0.1mol/2的NaOH溶液完全反应,R元素的原子中,质子数与中子数相等,在周期表中元素A、B与R同周期左右相邻,元素C、D与R同主族上下相邻,试确定:
(1)R、A、B、C、D各为何元素?
(2)比较R、C、D三种元素气态氢化物的稳定性大小?
(3)由R和C两元素形成的两种化合物分子中,指出它们各属于何种分子?
16.现有短周期A、B、C三种元素,原子序数依次增大,A元素的单质是密度最小的气体,B获得2个电子可达到稳定结构,C与A同主族。
(1)判断A、B、C各为何种元素。
A______________ B______________ C______________
(2)用电子式表示三种元素原子之间可能构成的化合物的形成过程,并指示各自化学键的类型:
①A与B______________、______________
②A与C______________
③B与C______________、______________
④A、B、C______________
15.A、B、C、D、E、F、G为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
A |
B |
C |
D |
E |
F |
G |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
电荷数(单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中:B的离子半径大于E的离子半径;D是由极性键构成的4原子极性分子;C与F可形成D和G分子。
(1)A微粒的结构示意图是______________。
(2)比较B和E相应元素的最高价氧化物对应水化物的碱性强弱,为______________>______________(用化学式表示)。
(3)D和G微粒是否为极性分子?答:______________。
(4)C微粒是______________,F微粒是______________(用电子式表示)。
14.已知磷酸分子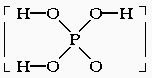 中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换,由此可推断出H3PO2的分子结构是( )
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换,由此可推断出H3PO2的分子结构是( )

13.对比以下几个反应式:Cl+Cl→Cl2+247KJ;O+O→O2+493KJ;N+N→N2+946J,可得出的结论是( )
A.在常温下N2比O2、Cl2稳定 B.氮、氧、氯的分子都是非极性分子
C.氮、氧、氯都是双原子分子 D.氮气、氧气和氯气的密度不同
C.能力训练
12.A、B、C、D四种元素,AB2分子中有22个电子,C离子中质子数比中子数少一个,11.5gC与足量水可放出H25.6L(标况下);D与C同周期,无延展性,但有一定的导电性,且在化合物中主要是共价键结合,下面叙述正确的是( )
A.DB2的熔点很低 B.C2B2有非极性键
C.晶体A一定是原子晶体 D.这四种元素原子序数只有一个奇数
11.下列叙述中正确的是( )
A.同主族金属元素的原子半径越大熔点越高
B.稀有气体原子序数越大沸点越高
C.分子间作用力越弱的分子其熔点越低
D.同周期元素的原子半径越小越易失去电子
10.实验测得BeCl2为共价化合物,两个Be-Cl键间的夹角为180°,由此可判断BeCl2属于( )
A.由极性键形成的极性分子 B.由极性键形成的非极性分子
C.由非极性键形成的极性分子 D.由非极性键形成的非极性分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com