
20.(14分)用下图所示装置进行实验,将A逐滴加入到B中:
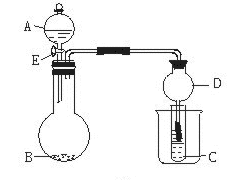
(1)若A为浓H2SO4, B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,则B是_____ __(填化学式),B与浓H2SO4反应的化学方程式为:__________________ ____________;
反应后往烧杯中加入沸水,又可观察到试管C中的现象为___________________。
(2)若B为大理石,C为漂白粉溶液,实验中观察到小试管内溶液变浑浊,则酸A与碳酸、次氯酸的酸性由强到弱的顺序为_______________________________;往小试管内加入品红溶液,可观察到试管C中的现象是____________________;然后往烧杯中加入沸水,观察到试管C中的现象是_____________________。
(3)若B是生石灰,C为加有酚酞的水溶液,实验中观察到C溶液变红,则A是________________
(填名称);然后往烧杯中加入沸水,可观察到试管C中的现象是___________________,B与生
石灰反应的化学方程式为 。
仪器D在此实验中的作用是___________________。
19.(8分)下列物质间在一定条件下发生如图所示的转化关系,其中A、B、C为中学化学中常
见元素的化合物,甲、乙、丙为单质。
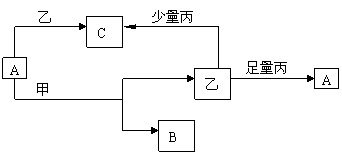
(1)若A在常温下是气体,甲元素的原子共有3个电子层,且最外层电子数是次外层电
子数的1/4,则C的化学式是____________;甲与A反应的化学方程式是______ _____________。
(2)若乙在常温下是液态,且上述反应均在溶液中进行,则C的化学式是_____________,
A与甲反应的离子方程式为________ ______________________。
18.(13分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z
是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为____________ ________。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为______________。
(3)W2Y化合物的水溶液显______性,用离子方程式解释原因___________________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_____________________ ____ ___。
(5)比较Y、Z气态氢化物的稳定性__ ___>_____ __(用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:_____ ______。
17.(6分)容积为10mL的试管中充满NO2和O2的混合气体,将试管倒立于盛水的水槽中,
(1)若水全部充满试管,则混合气体中NO2与O2的体积比为___ _____;
(2)若最后剩余气体1mL,则原混合气体中NO2的体积可能是____ __mL或_______mL。
16.(6分)下列三组试剂已失去标签,分别用一种试剂可以鉴别,请选择适当的试剂鉴别。
①H2O ②稀H2SO4 ③紫色石蕊试液 ④NaOH溶液
A、AlCl3、NaCl、Na2CO3三种溶液,可选用______________(填序号,下同);
B、 Na2CO3、Na2SO4、BaCl2、NaA1O2四种溶液,可选用__________ ___;
C、 CaC2、NaCl、CuSO4、CaCO3四种固体,可选用______________。
15.将5.6g铁粉放入一定量某浓度的硝酸溶液中,待铁粉全部溶解后,共收集到NO、NO2(其它气体忽略不计)混合气体0.15mol,该混合气体中NO与NO2 的体积比可能是
A.1:2 B.2:1 C.3:2 D.3:1
第II卷(非选择题,共55分)
14.使18g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积。已知:
C(固)+1/2O2(气)=== CO(气);H=Q1KJ/mol,
CO(气)+1/2 O2(气)=== CO2(气);H=Q2KJ/mol,
这与18g克焦炭完全燃烧时相比较,损失的热量是
A.1/3 Q1KJ B。1/3Q2KJ
C.1/3(Q1+ Q2)KJ D。1/2 Q2KJ
13.下列热化学方程式中的反应热划下线处表示燃烧热的是
A.NH3(g)+5/4O2(g) === NO(g)+6/4H2O(g); DH=-a kJ / mol
B.C6H12O6(s)+6O2(g) === 6CO2(g)+6H2O(l); DH=-b kJ / mol
C.2CO(g)+O2(g) === 2CO2(g); DH=-c kJ / mol
D.CH3CH2OH(l)+1/2O2(g) === CH3CHO(l)+H2O(l); DH=-d kJ / mol
12.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(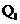 、
、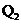 均为正值):
均为正值):
 H2(g)+Cl2(g)=== 2HCl(g);△H= -Q1 kJ/mol
H2(g)+Cl2(g)=== 2HCl(g);△H= -Q1 kJ/mol
H2(g)+Br2(g)=== 2HBr(g);△H= -Q2kJ/mol
 有关上述反应的叙述正确的是
有关上述反应的叙述正确的是
 A.Q1<Q2
A.Q1<Q2
 B.生成物总能量均高于反应物总能量
B.生成物总能量均高于反应物总能量

 C.生成1molHCl气体时放出
C.生成1molHCl气体时放出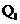 热量
热量
 D.1mol
HBr(g)具有的能量大于1mol HBr(1)具有的能量
D.1mol
HBr(g)具有的能量大于1mol HBr(1)具有的能量
11.同温同压下,等质量的硫粉和硫蒸气分别在足量的氧气中燃烧生成SO2,放出的热量分别为Q1和Q2,则Q1和Q2的大小关系为
A.Q1>Q2 B. Q1<Q2. C.Q1=Q2 D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com