
24.向8克二价金属的氧化物固体中加入稀硫酸,使其恰好完全溶解,已知所消耗的硫酸体积为100毫升,在所得溶液插入铂电极进行电解,通电一定时间后,在一个电极上收集到224毫升(标准状况)氧气,在另一个电极上得到1.28克该金属。 (1)根据计算确定金属氧化物的名称。 (2)计算通电后硫酸溶液的物质量浓度(溶液体积按100毫升计算)。
23.(6分)全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4。某学生想探究铁生锈的条件,他将干净的铁钉分别同时入放A.B.C三支试管中进行研究。
(1)请你帮助该学生完成下列实验设计的内容:
|
编号 |
操作方法 |
实验目的 |
|
A |
|
探究铁在干燥空气中的生锈情况 |
|
B |
放入铁钉,注入蒸馏水浸没铁钉,并用植物油液封 |
|
|
C |
|
探究铁在有空气和水封时的生锈情况 |
(2)一周后,编号为________的试管中的铁钉最易生锈。
(3)用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在南方比安装在北方更易生锈,其原因是__________________________________________________。
(4)在焊接铁管时,为了使接口更加牢固,常用稀盐酸清洗接口处的铁锈,该反应的化学方程式为________________________________。
22.(6分)银器皿日久表面逐渐变黑色,这是由于生成了硫化银(Ag2S)。有人设计用原电池的原理进行“抛光”,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银恢复光泽,且不会损失。试回答:
⑴食盐的作用是______________________。
⑵在此原电池反应中,负极发生的电极反应为__________________________________,正极发生的电极反应为__________________________________。
⑶反应过程中产生臭鸡蛋气味的气体,溶液中发生的反应为2Al3++3S2-+6H2O==2Al(OH)↓+3H2S↑,则原电池总反应方程式为
____________________________________________。
21.(6分)从H+.Na+.Cu2+.Ba2+.Cl-.SO42-离子中,选出恰当的离子组成一种电解质,将电解质溶液按下列要求进行电解(均是惰性电极):
(1) 电解时电解质含量减小,水量不变,则所采用的电解质是 ;
(2)电解时电解质的质量保持不变,水量减小,则所采用的电解质是 ;
(3)电解时电解质和水的质量都发生变化,则所采用的电解质是 ;
20.(9分)实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2。
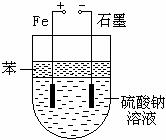
(1)制取前需将Na2SO4溶液煮沸,目的是________________________________。
(2)在Na2SO4溶液上覆盖一层苯的目的是________________________________。
(3)阳极的电极反应式是:_________________________________,阴极的电极反应式是________________________________;阳极材料能否换成其他材料?________。
(4)电解一段时间后,若将电极反接(即铁棒和电源负极相连.石墨棒和电源正极相连),电极反应为:阳极_______________________,阴极
_______________________。U型管中看到的现象是
____________________________________________,发生这一现象的化学方程式是_______________________________________。
19.(6分)原电池的正负极的判断:
①由组成原电池的两极材料判断。一般是 的金属为负极,活泼性 的金属或能 的非金属为正极。
②根据电流方向或电子流动方向判断。电流是由 流向 ;电子流动方向是由 极流向 极。
③根据原电池里电解质溶液内离子的定向流动方向。在原电池的电解质溶液内,阳离子移向的极是 极,阴离子移向的极为 极。
④根据原电池两极发生的变化来判断。原电池的负极总是 电子发生氧化反应,其正极总是 电子发生 反应。
18.(2分)下列事实不能用电化学理论解释的是______
①轮船水线以下的船壳上镶嵌有一定量的锌块
②镀锌的铁制品比镀锡的铁制品耐用
③铝片不用特殊方法保存
④常温下铝跟稀硫酸快速反应,跟浓硫酸几乎不反应
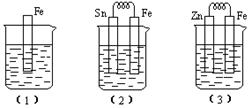
17.(7分)如下图所示,烧杯中都盛有稀硫酸。
(1)中反应的离子方程式为 ,
(2)中的电极反应:Fe: .Sn:
Sn极附近溶液的pH(填增大.减小或不变) ,
(3)中被腐蚀的金属是 .其电极反应式为 。
比较(1).(2).(3)中纯铁被腐蚀的速率由快到慢的顺序是
16.(6分)锌银电池:负极是 ,正极是 ,电解质是 ,其电极反应如下:
负极: ,
正极: ,
总反应:
15.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提上议事日程,其首要原因是
A.利用电池外壳的金属材料
B.防止电池中汞.镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com