
1、 了解化学实验常用仪器的主要用途和使用方法。
21.(12分)用50 mL 0.50mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液,在如图所示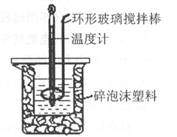 的装置中进行中和反应,测定强酸与强碱反应的反应热。
的装置中进行中和反应,测定强酸与强碱反应的反应热。
|
|
起始温度t1/℃ |
终止温度t2/℃ |
温度差 (t2-t1)/℃ |
||
 |
 |
平均值 |
|||
|
1 |
25.5 |
25.0 |
25.25 |
28.5 |
3.25 |
|
2 |
24.5 |
24.2 |
24.45 |
27.6 |
3.15 |
|
3 |
25.0 |
24.5 |
24.75 |
26.5 |
1.75 |
(1)在该实验中,量取50 mL盐酸或NaOH溶液,需要用到的玻璃仪是 ;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是 ;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指 温度;
(4)计算该实验发生中和反应时放出的热量为 kJ[中和后生成的溶液的比热容c=4.18 J·(g·℃)-1,稀溶液的密度都为1 g·cm-3];
(5)如果用50 mL 0.55 mol·L一的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 。

20.(10分)沼气是一种廉价的能源。农村富有秸秆、杂草等废弃物,它们经微生物发酵之后,便可以产生沼气,可以用来点火做饭。
(1)已知: ;∆H<0。请评价这个反应的实际价值与意义:
。(至少两点)
;∆H<0。请评价这个反应的实际价值与意义:
。(至少两点)
(2)煤的主要成分是碳,写出煤和沼气中的主要成分燃烧过程的化学方程式:
,
并指出哪一种燃料对环境的污染小? 。
(3)8g甲烷完全燃烧生成液态水时能放出445kJ的热量,写出甲烷燃烧生成液态水时的热化学反应方程式:
(4)若建立沼气发电站,则可以实现把 转化为电能。
19.(10分)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有: 。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O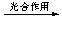 C6H12O6
+6O2 b.CO2
+ 3H2
C6H12O6
+6O2 b.CO2
+ 3H2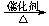 CH3OH
+H2O
CH3OH
+H2O
c.CO2 +
CH4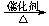 CH3COOH
d.2CO2
+ 6H2
CH3COOH
d.2CO2
+ 6H2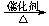 CH2==CH2
+ 4H2O
CH2==CH2
+ 4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)已知0.5molCO2与0.5mol水蒸 气在t℃、pkPa时,完全反应生成液态HCOOH和氧气,吸收了a kJ热量,该反应的热化学方程式是
。
气在t℃、pkPa时,完全反应生成液态HCOOH和氧气,吸收了a kJ热量,该反应的热化学方程式是
。
18.(10分)(1)室温下,将1g苯(C6H6)完全燃烧生成液态水和CO2,放出41.8kJ的热量,写出C6H6燃烧的热化学方程式 。
(2)今有两个氢气燃烧生成水的热化学方程式
H2(g)+1/2O2(g) ==H2O(g) △H=a kJ/mol
2H2(g)+O2(g) ==2H2O(l) △H=b kJ/mol
请回答下列问题:(提示:︱b︱表示b的绝对值)
①若2 molH2完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)︱b︱kJ
②反应热的关系:2a b(填“>”、“<”或“=”)。
③ 若已知H2(g)+1/2O2(g) ==H2O(g) △H=-242 kJ/mol ,且氧气中1mol氧氧键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收的热量为
17. (10分)(1)右图是等质量的Na2CO3、NaHCO3粉末分别与足量的盐发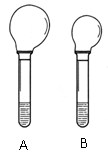 生反应时的情景,产生CO2气体的体积较多的试管中加入的固体试剂是________,当反应结束时,A、B两试管中消耗的盐酸的质量之比为__________。
生反应时的情景,产生CO2气体的体积较多的试管中加入的固体试剂是________,当反应结束时,A、B两试管中消耗的盐酸的质量之比为__________。
实验过程中我们还能感受到Na2CO3与盐酸反应时是放热反应,而NaHCO3与盐酸反应时表现为吸热。在A、B两试管中的此反应过程中,反应体系的能量变化的总趋势分别对应于A-____,B-____。(填写a或b)
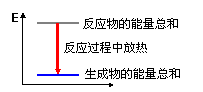
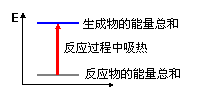
(a)  (b)
(b)
(2)若Na2CO3 (aq) + HCl(aq) == NaHCO3(aq) + NaCl(aq) + Q1 ,
NaHCO3(aq) + HCl(aq) == NaCl(aq) + H2CO3(aq) + Q2 ,
H2CO3(aq) == H2O(l) + CO2(g) – Q3
注:aq- 表示溶液中、 l- 表示液体、 g- 表示气体
试根据上述两组实验现象分别可得出的与Q1、Q2、Q3有关的不等式为:
_____________、________________。
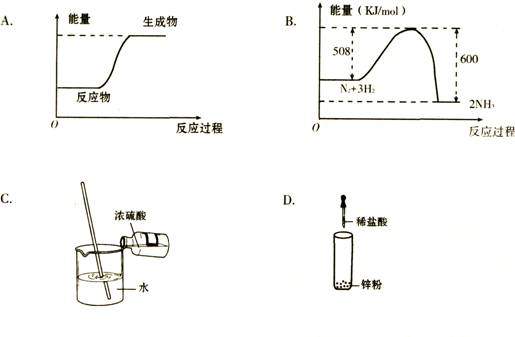
16.下列图示变化为吸热反应的是
15.用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是:①幕布的着火点升高;②幕布的质量增加;③氯化铵分解吸收热量,降低了温度;④氯化铵分解产生的气体隔绝空气
A.①② B.③④ C.①③ D.②④
14.化学反应中一定伴随着能量的变化,下列有关能量的说法正确的是
A.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多
B.由C(石墨) C(金刚石)-1.9KJ可知,金刚石比石墨稳定
C(金刚石)-1.9KJ可知,金刚石比石墨稳定
C.根据热化学方程式:S(s) + O2(g)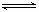 SO2(g) + 297.23 kJ,可推知1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和
SO2(g) + 297.23 kJ,可推知1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和
D.在稀水溶液中 H+(aq)+OH-(aq)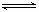 H2O(l)+57.3 kJ,将含0.5 mol H2SO4的浓硫酸与含l mol
NaOH的溶液混合时,放出的热量大于57.3 kJ
H2O(l)+57.3 kJ,将含0.5 mol H2SO4的浓硫酸与含l mol
NaOH的溶液混合时,放出的热量大于57.3 kJ
13.直接测定同素异形体相互转化的反应热是很困难的。盖斯定律指出:“不管化学过程是一步完成还是分几步完成,其总过程的热效应是相同的”。已知:
P4(固、白磷)+5O2(气) → P4O10(固)+2983. 2KJ
2KJ
P(固、红磷)+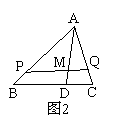 O2(气) →
O2(气) →  P4O10(固)+738.5KJ
P4O10(固)+738.5KJ
那么,1摩白磷转变成相应物质量的红磷时,应是
A.放出29.2KJ热量 B.吸收29.2KJ热量
C.放出2244.7KJ热量 D.吸收2244.7KJ热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com