
2.常见物质的检验
物质的检验通常有鉴定、鉴别和推断三类,它们的共同点是:依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理。
(1)常见气体的检验:
常用的方法是观察法、气味法、试纸法、点燃法等。如鉴别Cl2、N2、NO2 NO 四种气体的方法是
(2)常见离子的检验:
① 某溶液含有Al3+、Mg2+、Ba2+、Ag+ 等4种阳离子,要将其逐步一一沉淀出来,依次加入的试剂(指离子)是 ;
② 某溶液中含有Cl-、SO42-、CO32-、OH- 等阴离子,仅取一次试样,要能将其一一鉴别,所加入的试剂依次是 。
(3)用一种试剂或不用试剂鉴别物质
用一种试剂来鉴别多种物质时,所选用的试剂必须能和被鉴别的物质大多数能发生反应,而且能产生不同的实验现象。常用的鉴别试剂有FeCl3溶液、NaOH溶液、Na2CO3溶液、稀H2SO4、Cu(OH)2悬浊液等。
(4)不用其他试剂来鉴别一组物质,一般情况从两个方面考虑:
①利用某些物质的特殊性质(如颜色、气味、溶解性等)首先鉴别出来,然后再用该试剂去鉴别其他物质。
②采用一种试剂与其他物质相互反应的现象不同,进行综合分析鉴别
5、Fe(OH)3胶体中的FeCl3 6、NaCl固体中的I2
(2)化学方法分离和提纯物质
用化学方法分离和提纯物质时要注意:
①最好不引入新的杂质;②不能损耗或减少被提纯物质的质量
③实验操作要简便,不能繁杂。用化学方法除去溶液中的杂质时,要使被分离的物质或离子尽可能除净,需要加入过量的分离试剂,在多步分离过程中,后加的试剂应能够把前面所加入的无关物质或离子除去。
3、乙酸乙酯中的碳酸钠 4、皂化液中的甘油
1、AgCl固体中的NaCl固体 2、KNO3固体中的NaCl固体
1.常见物质的分离和提纯
(1)物理方法分离和提纯物质
限用物理方法,除去以下物质中的杂质
综合运用化学知识对常见的物质(包括气体物质、无机离子)进行分离、提纯和鉴别。
9、硫酸铜的制备实验是无机化学实验教学中一个必做实验,某研究性学习小组设计了如下两个实验方案:
实验一:
因铜不能与稀硫酸直接反应,实验中以浓硝酸分次加入到铜和稀硫酸的混合液中,加热使之完全反应,通过蒸发、析晶等操作得到硫酸铜晶体。
(1)浓硝酸所起的作用是___________________________________
(2)该反应的原理是(用化学方程式表示)
______________________________________________ 。
实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太小,当升高温度到80-90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
(3)用离子方程式表示速率明显加快的原理
______________________________________________ 。
Fe2(SO4)3的作用是__ 。
(4)得到的混合液用______________调节pH =2-4,使Fe3+形成Fe(OH)3沉淀而除去,且Fe(OH)3可以循环使用。
(5)请根据以上内容,对这两个实验方案进行评价,填下表:
|
|
实 验 一 |
实 验 二 |
|
主要优 点 |
|
|
|
主要缺 点 |
|
|
第4讲:物质的检验、分离和提纯
8、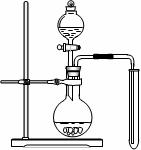 为了在实验室模拟用二氧化氮溶于水生成硝酸,现进行如下实验:
为了在实验室模拟用二氧化氮溶于水生成硝酸,现进行如下实验:
实验一:制备并收集一试管二氧化氮
(1)实验室常用浓硝酸与铜反应制备二氧化氮,化学方程式是 。
(2)可用右图装置制备并收集一试管二氧化氮,
① 在加入药品前,必须进行的操作是
。
② 该装置的缺点是(只填一个缺点既可)
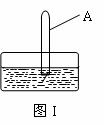 实验二:尽可能多地使试管中的二氧化氮被水吸收
实验二:尽可能多地使试管中的二氧化氮被水吸收
(3)将装有二氧化氮的试管A倒插入水中(图I),并轻轻晃动试管,观察到的现象是:
反应的化学方程式是 。
(4)从下图中挑选所需的仪器,完成制取O2,并将O2通入到上述实验后的试管A中。
①画出制取O2装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明所用试剂。
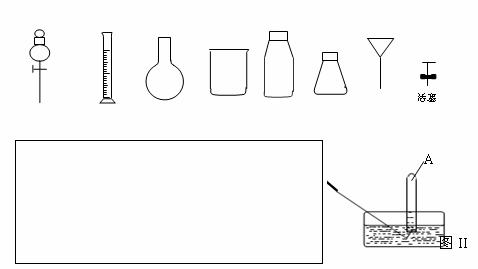
②某同学在图II的试管A内通入O2的过程中没有观察到液面上升,而是试管内充满了无色气气体,主要原因是 。
7、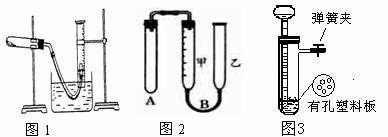
(1)如何检查上述图1装置的气密性?
。
(2)以下是测量收集到气体体积(上图1)必须包括的几个步骤;
① 调整量简内外液面高度使之相同;
②使试管和量筒内的气体都冷却至室温;
③读取量简内气体的体积。
这三步操作的正确顺序是: (请填写步骤代号)。
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同?
(4)用一定质量的Zn(分片状和粒状)、浓硫酸、水以及如图2装置制取H2,要保证不漏出 H2,应如何操作
如何检查上述装置的气密性?
(5)用上图中图3的装置制取氢气,在塑料隔板上放粗锌粒,漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹,则酸液由漏斗流下,试管中液面上升与锌粒接触,发生反应。产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止。需要时再打开弹簧夹,又可以使氢气发生。这是一种仅适用于室温下随制随停的气体发生装置。
回答下面问题:
① 为什么关闭弹簧夹时试管中液面会下降?
② 这种制气装置在加入反应物前,怎样检查装置的气密性
6、右图所示的A、B两支大试管中各盛有等质量的同一种液体,试管
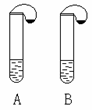 口各系有一个小气球,气球内分别装有等质量的不同固体(纯净物),
口各系有一个小气球,气球内分别装有等质量的不同固体(纯净物),
实验时将两气球抬起,将其中固体同时倾入试管内,固体全部溶解,同时看到两气球都鼓气胀大,但A试管气球胀大的速度及最终胀大的体积都明显大于B。若两试管产生同一种气体,试推测A、B中盛放的液体和固体的可能组合,将各组合填入下表,要求各组分产生的气体不能相同。(可以不填满)
|
组合编号 |
A、B中的液体 |
A中的固体 |
B中的固体 |
产生的气体 |
|
① |
|
|
|
|
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com