
1.为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计了下列4种实验装置,请回答下列问题:
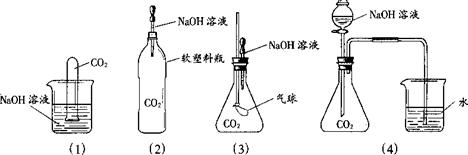
(1)选择实验装置(3),简述出现的实验现象以及产生该实验现象的原因:_______________________________ 。
⑵某同学质疑上述所有实验设计,该同学质疑的依据是______________________________ _
⑶在原实验的基础(4)上,请你设计实验证明CO2和NaOH肯定发生了化学反应。____________________________________________________________________________ 。
|
|
例1已知Cu2S、CuS粉末的颜色和CuO粉末相似,且都不溶于水。在空气中煅烧Cu2S和CuS都转化为SO2和CuO。试根据上述性质,设计一个鉴别Cu2S、CuS和CuO三种黑色粉末的简单的实验方案。
例2学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:_________________________________________________
II实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、________、________、________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算到标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:
(1) 在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、
_________ 、_______ _
(2)实验编号3的实验中KClO3的分解率为_________%(保留一位小数)
(3) 在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用______________试纸检验。上述异常现象产生的原因是___________________________________。
VI 实验结论:______________________________________________________
例3某研究性学习小组为探究铜、锌与浓盐酸反应,设计实验探究方案如下:
3.实验设计方案的评价:
①科学性(即实验原理、操作程序和方法必须正确);
②安全性(即用药及操作要注意安全,注意环境保护等问题);
③可行性(要满足中学现有的实验条件);
④简约性(装置简单、步骤少、药品用量少、时间短)。
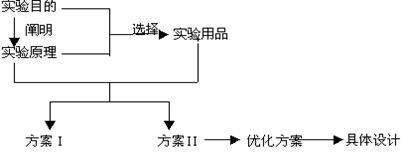
2. 实验设计方案的思路
(1)制备实验方案的设计思路
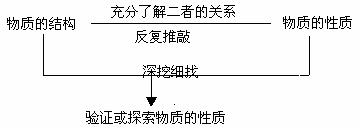
(2)性质实验方案的设计思路
(3)物质检验实验方案的设计思路
①对试样进行外观观察,确定其颜色、气味、状态等。
②准备试样进行检验,当试样是固体时应先取少量配成溶液,同时观察试样是否溶解,在溶解时有无气体产生等,以初步判断试样可能含有哪类物质。
③ 根据实验现象得出结论。
1.化学实验方案设计的内容
一个相对完整的化学实验方案设计包括下述内容:
(1)实验 (2)实验 ;(3)实验 ;(4)实验 (仪器、药品及规格);(5)实验 (包括实验仪器装配和操作);(6)实验 ;(7)问题讨论
掌握化学实验的 记录方法和运用化学知识设计一些基本实验。具体为:
(1)根据实验现象,观察、记录、分析或处理数据,得出正确结论。
(2)根据实验试题要求,设计或评价实验方案。
(3)能绘制和识别典型的实验仪器装置图。
10.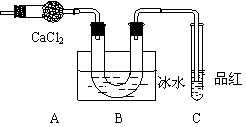 某学生设计如下实验,用于检验硫酸亚铁晶体(FeSO4·nH2O)分解产物并测定其结晶水的n值,步骤如下:
某学生设计如下实验,用于检验硫酸亚铁晶体(FeSO4·nH2O)分解产物并测定其结晶水的n值,步骤如下:
① 在质量为m1g的某容器中放入适量的
已研碎的硫酸亚铁晶体,再称量为m2g;
② 在隔绝空气的条件下,将晶体强热,
并将气态产物通过如下装置(设每步吸收均
是完全的),直至晶体全部变为红棕色粉末
为止,发现U形管底部有无色晶体析出,
品红溶液褪色。
③ 将红色粉末冷却至温室,称量(连容器)为m3g
④ 重复加热、冷却、称量、直至合格为止
回答下列问题:
(1) 第①步实验中盛放晶体的容器是(从下列选出)
A.坩埚 B. 蒸发皿 C. 烧瓶 D. 石英试管
(2) 第③步实验应如何冷却? ;
(3) 第④步实验称量合格的标准是 ;
(4) 求n值的计算式是 ;
(5) U形管中的晶体可能是什么物质?如何检验? ;
(6) 根据实验结果,写出FeSO4·nH2O分解化学方程式(化学计量数可用n表示)
第5讲:化学实验方案设计与评价
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com