
29、(12分)利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:
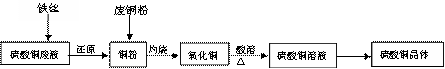
试回答下列问题:
(1) 废铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂是 ,该还原反应的化学方程式是
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是
28、(12分)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2  2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的生成速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.生高温度
(3)混合气体通过过量NaOH溶液,气体体积减少了21.28L,该减少的气体是:
(4)反应达到平衡时生成SO3的物质的量是:
(5)求该反应达到平衡时SO2的转化率(用百分数表示)
(6)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀 克
27、(4分)(1)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃10kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧的热化学方程式:
(2)已知:CH3OH+Cr2O72-+8H+
CO2↑+2Cr3++6H2O
写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
26、足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与15.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入 5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.600mL B.450mL C.560mL D.150mL
25、将几种铁的氧化物的混合物投入到7mol/l的盐酸100 ml 中。恰好完全溶解 ,在所得的溶液中再通入0.56L(标况)氯气时,刚好使溶液中Fe2+ 完全转化为Fe3+ 。则该混合物中铁元素的质量分数为( )
A 74.1% B 72.4% C 71.4% D 63.6%
24、下列表述中正确的是( )
A.1mol NaOH分别和1mol CH3COOH、1molHNO3反应,后者比前者放出的热量多
B.由C(石墨)→C(金刚石)△H=+119kJ·mol-1可知,金刚石比石墨稳定
C.在AgNO3溶液中加入过量的稀盐酸后,溶液中不存在Ag+
D. 任何能使熵值增大的过程都能自发进行
23、将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是 ( )

A.CO2 B.NH3
C. C12 D.H2S
22、在溶液中加入足量Na2O2后仍能大量共存的离子组是(
)
A.NH4+、Ba2+、Cl-、NO3- B. Na+、Cl-、NO3-、SO32-
C.Ca2+、Mg2+、NO3-、HCO3- D.
K+、AlO2-、Cl-、SO42-
21、在火星上工作的美国勇气号、机遇号探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水,以下叙述正确的是( ) 
A.铝热剂就是单指Fe2O3粉和铝粉的混合物
 B.检验从火星上带回来的红色物质是否是Fe2O3操作步骤为:样品→粉碎→加稀硫酸溶解→过滤→向滤液中滴加KSCN溶液
B.检验从火星上带回来的红色物质是否是Fe2O3操作步骤为:样品→粉碎→加稀硫酸溶解→过滤→向滤液中滴加KSCN溶液
C.分别还原amol Fe2O3所需H2、A1、CO的物质的量之比为1:2:3
D.明矾属硫酸盐,含结晶水,是混合物
19、运用元素周期律分析下面的推断,其中推断错误的是 ( )
A.氢氧化铍(Be(OH)2)的碱性比氢氧化镁弱
B.砹(At)为有色固体;HAt不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com