
5. 右图是函数
右图是函数 的图象的一部分.则其函数解析式为
( )
的图象的一部分.则其函数解析式为
( )
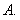

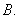

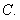
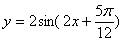
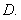
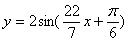
4.设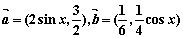 ,且
,且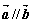 ,则锐角
,则锐角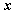 为( )
为( )
A.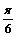 B.
B.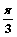 C.
C.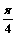 D.
D.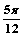
3.甲、乙两种水稻试验品种连续4年的单位面积平均产量如下:
|
品种 |
第1年 |
第2年 |
第3年 |
第4年 |
|
甲 |
9.8 |
9.9 |
10.2 |
10.1 |
|
乙 |
9.7 |
10 |
10 |
10.3 |
其中产量比较稳定的水稻品是 ( )
A甲 B乙 C一样 D无法比较
2.一个容量为20的样本数据分组后,组距与频数如下:(10,20),2;(20,30),3;(30,40),4;(40,50),5;(50,60),4;(60,70),2。则样本在区间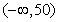 上的频率 ( )
上的频率 ( ) .0.20
.0.20
 .0.25
.0.25
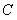 . 0.50
. 0.50
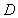 . 0.70
. 0.70
1.已知集合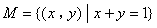 ,
,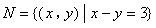 ,则
,则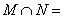 ( )A.
( )A. B.
B.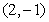 C.
C.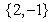 D.
D.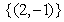
25.(10分)已知:
① 醛在一定条件下可以两分子加成:
 RCH2CHO + RCH2CHO →
RCH2CH--CH2CHO ,产物不稳定,受热即脱水而成为
RCH2CHO + RCH2CHO →
RCH2CH--CH2CHO ,产物不稳定,受热即脱水而成为
 不饱和醛RCH2CH=CHCHO。
不饱和醛RCH2CH=CHCHO。
②A是一种芳香醛。
根据下图所示转化关系填空(所有无机物均已略去)
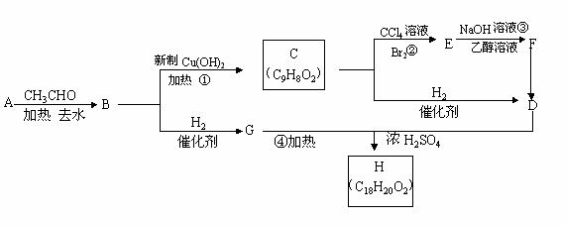
(1)写出B、F的结构简式:
B ;
F 。
(2)写出反应②和③的反应类型:
② ;③ 。
(3)写出G、D反应生成H的化学方程式:___________________________________________________________________。
(4)F若与H2发生加成反应,每摩F最多消耗的H2的物质的量为 mol。
24. (12分)现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
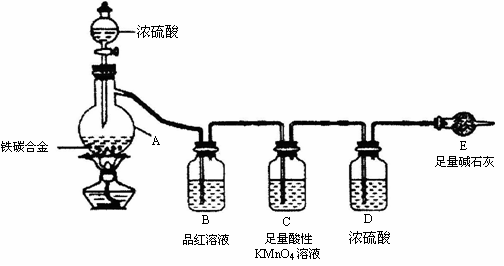
I 测定铁的质量分数:
(1)称量E的质量,并按图示连接装置,是否需要检查装置的气密性________(填“是”或“否”);
(2)装置C的作用________________________________________________;
(3)将a g铁碳合金样品放入A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g,铁碳合金中铁的质量分数为_________(写表达式)
(4)某同学认为:依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,可能的原因是空气中CO2、H2O进入E管使b增大。请问该同学的观点是否正确___________(填“是”或“否”)。
Ⅱ 探究浓硫酸的某些性质:
(5)未点燃酒精灯前,A、B 均无明显现象,其原因是:__________________;点燃酒精灯一段时间后,A、B 中可观察到明显的现象,B中的现象是_________________;A中发生反应的化学方程式(只写一个)__________________________ 。
23.(6分)氯、溴、碘同属于周期表中的VII A族,在上个世纪,人们很早就制得高碘酸及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2和KBrO3首先制得纯净的KBrO4晶体。
(1)高碘酸盐(IO65-)能在酸性条件下将Mn2+氧化为MnO4-(本身被还原成I03-),其反应平稳而迅速,写出离子反应方程式
。
(2)在25℃,已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L-1的碘酸或高锰酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。则高碘酸是 ;高锰酸是
(填“强酸”或“弱酸”)。
(3)写出XeF2和含KOH、KBrO3的水溶液反应得到KBrO4的离子方程式:--------------------------- _________________________________________________________________________
22.(12分) A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为l∶1和1∶2的两种离子化合物X、Y,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:

(1)X的电子式为: ,C的原子结构示意图为 ,
A、B的气态氢化物更稳定的是 (填化学式).
(2)单质D在CO2中燃烧的化学方程式为 .
(3) 2 mol C的氢氧化物与2 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式 .
(4)常温下,B、C形成的化合物的水溶液中所有离子的物质的量浓度由大到小的顺序为 .
21.(10分)由短周期元素构成的常见离子,它们组成A、B、C、D四种物质,分别溶于水。已知:
①A、C的焰色反应呈黄色
②取A、B溶液,分别加入BaCl2溶液,均生成白色沉淀,再加入稀HNO3,A中沉淀溶解,并产生能使澄清石灰水变浑浊的无色、无臭气体,而B中无变化。
③在D的稀溶液中加入AgNO3溶液和稀HNO3,有白色沉淀生成。
④在D溶液中滴加C溶液,生成白色沉淀,继续滴入C,白色沉淀消失。
⑤A、B、C溶液的物质的量浓度相等,当A、B溶液以体积比1∶2混合时,生成无色气体;B、C溶液以体积比1∶2混合时,也生成无色气体,此气体能使湿润的红色石蕊试纸变蓝色;如果均以体积比1∶1混合,两者都不生成气体。
(1)写出A、B、C、D的化学式:
A____________,B____________,C____________,D____________。
(2)写出D溶液中不断滴入C溶液的离子方程式:_________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com