
14.黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量‘Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O == SO2- + 2Fe2+ + 4H+
Cr2O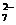 + 6 Fe2+ +
14 H+ == 2 Cr3+ +
6 Fe3+ + 7 H2O
+ 6 Fe2+ +
14 H+ == 2 Cr3+ +
6 Fe3+ + 7 H2O
⑴.样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵.若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 ,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:______________________________________________________________________。
⑶.煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸质量为__________ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
13.1840年盖斯指出:若是一个反应可以分几步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。请回答:
⑴ 已知热化学方程式:C(S,金刚石)+ O2(g)= CO2(g) △H = -395.41KJ/mol
C(S,石墨)+ O2(g)= CO2(g) △H = -393.51KJ/mol
则金刚石转化为石墨的热化学方程式为____________________,由热化学方程式看来更稳定的碳的同素异形体是____________________
⑵ 燃烧3.1g白磷比燃烧3.1g红磷放出的热量多1.839KJ,则白磷转化为红磷的热化学方程式是____________________________,相同温度下,能量状态最低的是__________。
12.已知下列两个热化学方程式:H2(g)+1/2O2(g)==H2O(l);△H= - 285.8KJ/mol,
C3H8(g)+5O2(g)==3CO2(g)+4H2O(l);△H= -2220.0KJ/mol,
⑴H2的燃烧热为 ,C3H8的燃烧热为 。
⑵实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态的水时放热6264.5KJ,则混合气体中H2和C3H8的体积比是 。
⑶1molH2和2molC3H8组成的混合气体完全燃烧释放的热量为: 。
⑷已知H2O(l)==H2O(g)△H= +44KJ/mol写出丙烷燃烧生成CO2和气态水的热化学方程式: 。
11.0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,其热化学方程式为: 。又知H2O(l)==H2O(g)△H= +44KJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是 KJ。
10.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。已知:N2(g) + 2O2(g)=N2O4(g); △H=+ 8.7kJ/mol N2H4(g) + O2(g)=N2(g) + 2H2O(g); △H=–534 kJ/mol 下列表示肼和N2O4反应的热化学方程式,正确的是 A. 2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g); △H=–1076.7 kJ/mol B. N2H4(g) + 1/2N2O4(g) =3/2N2(g) + 2H2O(g); △H=–1076.7 kJ/mol C. 2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g); △H=–542.7 kJ/mol D. 2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g); △H=–1059.3 kJ/mol
9.以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+5/2 O2=2CO2(g)+H2O(l);△H =-1300kJ/mol的说法中,正确的是
A.有10NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
8.X、Y二元素的原子,当它们分别获得两个电子形成稀有气体元素原子层结构时,X放出的热量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量W大于Z。则X、Y和Z、W分别形成的化合物中,离子化合物可能性最大的是
A.Z2X B.Z2Y C.W2X D.W2Y
7.下列关于能量转换的认识中不正确的是
A.电解水生成氢气和氧气时,电能转化为化学能
B.绿色植物进行光合作用时,太阳能转化为化学能
C.煤燃烧时,化学能主要转化为热能
D.白炽灯工作时,电能全部转化为光能
6.已知胆矾溶于水时,溶液温度降低。在室温下将1mol无水硫酸铜制成溶液时,放出热量为Q1kJ,而胆矾分解的热化学方程式是CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q2kJ/mol,则Q1与Q2的关系是
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2 D.无法确定
5.已知:
①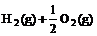 =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·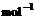 ,
,
②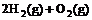 =2H2O(g)△H2=b kJ·
=2H2O(g)△H2=b kJ·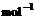 ,
,
③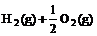 =H2O(l) △H3=c kJ·
=H2O(l) △H3=c kJ·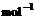 ,
,
④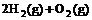 =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·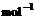 。
。
下列关系式中正确的是
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com