
31、(8分)在密闭容器中,投入一定量的NO2加热到某温度时,可进行如下反应:
2NO2 2NO+O2,在平衡时各物质的浓度分别是:c(NO2)=0.06mol/L,c(NO)=0.24mol/L。
2NO+O2,在平衡时各物质的浓度分别是:c(NO2)=0.06mol/L,c(NO)=0.24mol/L。
试求:⑴该温度下反应的平衡常数;
⑵开始时NO2的浓度;
⑶NO2的转化率。
30、(14分)Ⅰ.某密闭容器中有如下可逆反应:2SO2(g)+O2(g) 2SO3 (g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中。
2SO3 (g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中。
⑴升高温度,v(正)________,v(逆)________,SO2 的转化率_________;
⑵保持容器内的压强不变,向容器中充入氩气,SO3的体积分数________,SO2的浓度________。
Ⅱ.在一个固定容积的密闭容器中,在一定温度下发生下列反应:A(g)+B(g) 2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为ω。在相同条件下:
2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为ω。在相同条件下:
⑴若在同一容器中加入2molA和4molB,则达平衡后C的物质的量浓度为_______mol/L;
⑵若在同一容器中加入0.5molC,要求平衡后C的浓度为0.5p mol/L,且C的体积分数为ω,则还应在容器中加入A____mol,B____mol;
⑶若在同一容器中加入a mol A、b mol B、c mol C,并要求平衡后C的浓度为p mol/L,C的体积分数仍为ω,则a、b、c应符合的关系式是______________、____________(其中一个只含a和b,另一个只含a和c)。
29、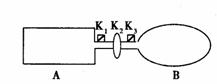 (14分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2(g)
(14分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2(g) N2O4(g);△H<0)
N2O4(g);△H<0)
⑴一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_________VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将__________(填:变大、变小、不变)。
⑵若在A、B中再充人与初始量相等的NO2,则达到平衡时,NO2的转化率αA将_________ (填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将_________,B中NO2的转化率将_________(填: 变大、变小、不变)。
⑶室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_________中的颜色较深。
⑷若在容器A中充人4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为_________ mol。
28、(4分)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如下图所示:
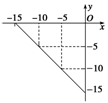
⑴该温度下,中性溶液的pH= 。
⑵该温度下0.01 mol/L NaOH溶液的pH= 。
27、(2分)已知:O2(g) = O2+(g)+e- △H1=+1175.7 kJ/mol
PtF6(g)+e-=PtF6-(g) △H2=-771.1 kJ/mol
O2PtF6(S)=O2+(g)+PtF6-(g) △H3=+482.2 kJ/mol
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的△H=_____________ kJ/mol。
26、(8分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制一定物质的量浓度的醋酸溶液
取冰醋酸配制250mL 0.2000mol/L的醋酸溶液,需要用到的玻璃仪器有量筒、烧杯、玻璃棒、
________________和______________。
实验二 探究浓度对醋酸电离程度的影响
将0.2000mol/L的醋酸溶液稀释成所需浓度的溶液,再用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
|
醋酸浓度(mol/L) |
0.0010 |
0.0100 |
0.0200 |
0.1000 |
0.2000 |
|
pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
⑴根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
___________________________________________________。
⑵从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度
____________。(填增大、减小或不变)
25、向Cr2(SO4)3水溶液中加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2-)。其平衡关系如下:
Cr3++3OH- Cr(OH)3
Cr(OH)3 CrO2-+H++H2O
CrO2-+H++H2O
(紫色) (灰绿色) (亮绿色)
向50 mL 0.05 mol/L的Cr2(SO4)3溶液中,加入1.0 mol/L的NaOH溶液50 mL,充分反应后(溶液体积变化忽略不计),溶液中可观察到的现象为:
A、有灰绿色沉淀 B、溶液为亮绿色
C、溶液为紫色 D、无法判断
第Ⅱ卷(非选择题 共50分)
24、某温度时,把1molN2O4气体通入体积为10L的真空容器,立即出现红棕色,反应进行4s时,NO2的浓度为0.04mol/L,再经过一段时间后,反应达平衡,这时容器内压强为开始时的1.8倍.则下列说法正确的是:
A、前4s中以N2O4的浓度变化表示的平均反应速率为0.01mol/L·s
B、在4s时容器内的压强为开始时的1.2倍
C、在平衡时容器内含N2O40.4mol
D、在平衡时容器内含NO21.6mol
23、向含有1 mol HCl和1 mol MgSO4的混合液中加入1 mol/L Ba(OH)2溶液,产生的沉淀与
Ba(OH)2的体积的关系图正确的是:
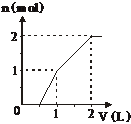

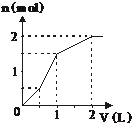
A B C D
22、 常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两个实验:
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两个实验:
(N2O4(g) 2NO2(g) △H>0)
2NO2(g) △H>0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,
正确的是:
A、(a)甲>乙 B、(b)甲>乙
C、(a)甲<乙 D、(b)甲<乙
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com