
6.如图4所示,物体在水平拉力F和地面滑动摩擦力的共同作用下,沿水平地面向右做匀加速直线运动.现让拉力F逐渐减小,则物体的加速度和速度的变化情况应是
A.加速度逐渐变小,速度逐渐变大
B.加速度和速度都在逐渐变小
C.加速度和速度都在逐渐变大
D.加速度先变小后变大,速度先变大后变小
5.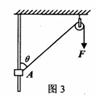 如图3所示,中间有孔的物块A套在光滑的竖直杆上,通过滑轮用不可伸长的轻绳将物体拉着匀速向上运动.则关于拉力F、拉力的移动速度
如图3所示,中间有孔的物块A套在光滑的竖直杆上,通过滑轮用不可伸长的轻绳将物体拉着匀速向上运动.则关于拉力F、拉力的移动速度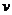 及拉力的功率P,下列说法正确的是
及拉力的功率P,下列说法正确的是
A.F不变、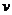 不变、P不变
不变、P不变
B.F增大、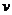 减小、P增大
减小、P增大
C.F增大、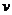 增大、P不变
增大、P不变
D.F增大、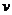 减小、P不变
减小、P不变
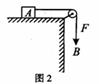
4.如图2所示,不计绳的质量及绳与滑轮的摩擦,物体A的质量为M,水平面光滑,当在绳端施以F=mg的竖直向下的拉力作用时,物体A的加速度为a1,当在B端挂一质量为m的物体时,A的加速度为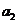 ,则
,则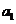 与
与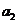 的关系正确的是
的关系正确的是
 A.
A.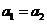
B.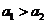
C.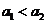
D.无法判断
3.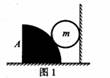 如图1,柱体A的横截面是圆心角为π/2的扇形面,其弧形表面光滑,而与地面接触的下表面粗糙;在光滑竖直墙壁与柱体之间放置一质量为m的球体,系统处于平衡状态.若使柱体向左缓慢移动少许(球体未与地面接触),系统仍处于平衡状态,则
如图1,柱体A的横截面是圆心角为π/2的扇形面,其弧形表面光滑,而与地面接触的下表面粗糙;在光滑竖直墙壁与柱体之间放置一质量为m的球体,系统处于平衡状态.若使柱体向左缓慢移动少许(球体未与地面接触),系统仍处于平衡状态,则
A.球对墙的压力减小
B.柱体与球之间的作用力增大
C.柱体所受的摩擦力减小
D.柱体对地面的压力减小
2.在地球大气层外有很多太空垃圾绕地球做匀速圆周运动,每到太阳活动期,由于受太阳的影响,地球大气层的厚度开始增加,而使得部分垃圾进入大气层,开始做靠近地球的近心运动,产生这一结果的主要原因是 ( )
A.由于太空垃圾受到地球引力减小而导致的近心运动
B.由于太空垃圾受到地球引力增大而导致的近心运动
C.由于太空垃圾受到空气阻力而导致的近心运动
D.地球的引力提供了太空垃圾做匀速圆周运动所需的向心力,故产生近心运动的结果与空气阻力无关
1.下列说法正确的是 ( )
A.一质点受到两个力作用且处于平衡状态(静止或匀速),这两个力在同一时间内的冲量一定相同;
B.一质点受两个力作用且处于平衡状态(静止或匀速),这两个力在同一时间内做的功或者都为零,或者大小相等符号相反;
C.在同一时间内,作用力和反作用力的功大小不一定相等,但正负号一定相反;
D.在同一时间内,作用力和反作用力的功大小不一定相等,正负号也不一定相反;
(1)离子--两种情况:带电荷的原子或原子团。
(2)化合价:单质中元素的化合价为0,化合价是元素在形成化合物时表现出来的一种性质。(常见元素、原子团的化合价)
(3)化学反应前后一定不变化的是:a原子的质量、b原子的个数、c原子的种类--元素的种类、d物质的总质量。
可能变化的是--分子的个数。
一定改变的是--分子的种类、物质的种类。
(4)常见铁矿石:赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、菱铁矿(FeCO3)、黄铁矿(FeS2)
(5)能量变化:
吸热:冰溶化、NH4NO3溶于水,CO2+C高温2CO; 放热:浓H2SO4溶于水、燃烧、CaO与水反应等。
化学能转化为电能:干电池放电、火力发电; 电能转化为化学能:电池充电、电解水。
(6)决定元素种类的是元素原子的质子数,而决定元素化学性质的是原子的最外层电子数。
(7)氢氧化钙和各种气体的溶解度随温度升高减小。
气体的溶解度随温度升高而降低,压强增大而增大。
(8)浓硫酸和硝酸与金属反应得不到氢气。
(9)化学肥料:氮肥(使作物生长茂盛,叶色浓绿)、磷肥(开花结果、提早成熟、籽粒饱满、根系发达、增强抗旱抗寒能力)、钾肥(生长健壮、茎杆粗壮、增强抗病虫害和抗倒伏能力,促进糖分淀粉的形成)、复合肥(含N、P、K三种元素中的两种或两种以上)。
(10)金属活动性顺序表:K Ca Na Mg Al 、Zn Fe Sn Pb (H) 、Cu Hg Ag Pt Au
验证方法:金属与酸反应、金属与盐反应。
(11)1-20号元素:
H He Li Be B、C N O F Ne、Na Mg Al Si P、S Cl Ar K Ca
(12)稀有气体:氦He、氖Ne、氩Ar、氪Kr、氙Xe
(13)金属与酸反应,溶液质量都增大。
(14)相同质量的金属与足量的酸反应,产生氢气的量由多到少:Al>Mg>Fe>Zn
(15)食品保质方法:真空包装、充入CO2或N2、加入生石灰或铁粉。
(16)中和反应的应用:改良土壤、处理污水、治疗胃酸过多等。
(17)氢能源的优点、存在的问题--成本高、不易贮存、解决方法--寻找光分解催化剂,利用太阳能分解水,研制新型贮氢合金材料。
(18)蛋白质燃烧后有烧焦羽毛的气味。
耐心细致!减少失误!放松答题!相信自己!
祝同学们考试成功!创造辉煌!
(1)量取液体:量筒放平、视线与凹液面的最低处保持水平。
仰视时,读数偏小;俯视时,读数偏大
(2)称量药品:a托盘天平能称准到0.1克;b干燥的药品,在天平两端各放一张相同质量的纸;c易潮解的药品放入小烧杯或表面皿中。
(3) 可直接受热的仪器有:试管、蒸发皿、燃烧匙、坩埚。
不能直接加热(垫石棉网):烧杯、烧瓶等。
不能加热:量筒、集气瓶等。
(4)过滤时:一贴、二低、三靠。
(5)检查装置的气密性的方法--加热法、注水法。
(6)测定溶液的pH:先取PH试纸放在玻璃片上,用玻璃棒(使用前后洗净擦干)蘸取待测液体滴在PH试纸上。
(7)检验气体纯度的方法:a收集一试管气体,用拇指堵住管口,b靠近酒精灯火焰,点火,c听到尖锐的爆鸣声,说明是不纯净的;听到噗噗的声音,表明是纯净的。
(8)氢气还原氧化铜,先通入氢气,排净空气,然后加热;实验结束,先停止加热,直到试管冷却再停止通氢气。
(9)酸和碱发生中和反应:在试管中先倒入氢氧化钠溶液,滴入1-2滴的酚酞试液,溶液会变红,然后用滴管逐滴滴入稀盐酸,并不断振荡,到溶液刚刚由红色变为无色为止。
(10) 浓硫酸具有吸水性,可作气体干燥剂。
稀释浓硫酸时,一定要把浓硫酸慢慢加入水中,并用玻璃棒不断搅拌。
(11)溶液在稀释过程中,溶质质量保持不变。
(12)溶液的配制的步骤:计算、称量、溶解、装瓶保存。
(13)粗盐提纯的步骤及玻璃棒的作用:溶解--搅拌加速溶解、过滤--引流液体、蒸发--使液体均匀受热,防止局部过热,造成液滴飞溅。
(14)药品保存:酸用玻璃塞、碱用橡皮塞、AgNO3溶液用棕色瓶(防止见光分解)。
 NaOH易潮解,并与CO2反应变质、浓H2SO4易吸水、浓HCl易挥发。
NaOH易潮解,并与CO2反应变质、浓H2SO4易吸水、浓HCl易挥发。
(15)除去气体中的杂质用洗气瓶,a进b出。
排水法收集气体,装满水,b进气a出水。
用向上排空气法收集气体,a进b出;用向下排空气法收集气体,b进a出。
(1)凡是生成盐和水的反应都是中和反应,复分解反应的一种。(×) 如酸性氧化物和碱、碱性氧化物和酸,都能生成盐和水。
(2)盐中都含有金属元素。(×) 如铵盐(NH4Cl)不含有金属元素。
(3)饱和溶液降温一定能析出晶体。(×) 氢氧化钙溶液不能。
(4)饱和溶液一定不饱和溶液浓度大。(×) 只有在相同的温度下,同一溶质的溶液中。
(5)含有碳元素的化合物都是有机物。(×) 有机物都含碳元素( )碳的氧化物、碳酸、碳酸盐除外,如酒精、蔗糖、醋酸、淀粉、蛋白质等。。
(6)含有氧元素的化合物就是氧化物。(×) 氧化物由两种元素组成,其中一种元素是氧元素,如水,氧化物是化合物中的一类
(7)有单质和化合物生成的反应都是置换反应。(×)反应物也必须是单质与化合物。
如:3CO+ Fe2O3 高温 2Fe + 3CO2是氧化还原反应,不是置换反应。
(8)玻璃钢是钢的一种。(×)它是塑料中加入玻璃纤维制成的复合材料。
(9)质子数相等的微粒一定属于同一种元素。(×)如:铵根与钠离子质子数相等。
(1)注意:元素符号、化学式的含义,化学符号中各个位置数字的意义--几个微粒、元素化合价、分子构成、离子所带电荷等。
如:H2--氢气、一个氢分子,2H2--两个氢分子;H--氢元素、一个氢原子;2H--两个氢原子,亚铁离子----Fe2+ 、铁离子----Fe3+等
(2)关于水的说法:①水由氢元素和氧元素组成,②水由水分子构成,③一个水分子由二个氢原子和一个氧原子构成。④电解水产生氢气和氧气的体积比为2:1,质量比为1:8。
(3)氧气由氧分子构成,二氧化碳中没有氧分子、水中也没有氧分子、而空气中含有氧分子。
(4)原子构成: 核电荷数===核内质子数===核外电子数;
相对原子质量===质子数+中子数
(5)元素只讲种类,不讲个数;原子既讲种类,又讲个数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com