
19.(5分)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,求酸溶液体积V(酸)和碱溶液体积V(碱)的关系。
18.(6分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是:Mg(OH)2(固)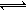 Mg2++2OH―…………①
Mg2++2OH―…………①
NH4++H2O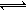 NH3·H2O +H+…………② H++OH―
NH3·H2O +H+…………② H++OH―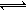 H2O…………③
H2O…………③
由于NH4+水解显酸性,H+与OH―反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是:Mg(OH)2(固)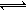 Mg2++2OH―……① NH4++OH―
Mg2++2OH―……① NH4++OH― NH3·H2O……②
NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH―结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由 。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
17.(8分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示):
_____________________ _____________________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
16.(5分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)。
15.(3分)物质的量浓度均为0.1 mol/L的下列溶液:①KNO3 、②Na2CO3 、③NaHCO3 、④NaHSO4 、⑤CH3COOH 、⑥NaOH 、⑦Ba(OH)2 、⑧NH4Cl ,pH由大到小的顺序为:
(填数字代号)
14.下列混合溶液中,各离子浓度的大小顺序的表示中,正确的是
A.10 mL 0.10 mol·L-1氨水与10 mL 0.10 mol·L-1盐酸混合
c(Cl-)> c(NH4+)> c(OH -) > c(H+)
B.10 mL 0.10 mol·L-1 NH4Cl溶液与5 mL 0.20 mol·L-1 NaOH溶液混合
c(Na+) = c(Cl-])> c(OH -)> c(H+)
C.10 mL 0.10 mol·L-1 CH3COOH溶液与5 mL 0.20 mol·L-1 NaOH溶液混合
c(Na+)= c(CH3COO-) > c(OH -) > c(H+)
D.10 mL 0.50 mol·L-1 CH3COONa溶液与6 mL 1.0 mol·L-1盐酸混合
c(Cl-) > c(Na+)> c(OH -) > c(H+)
13.下列操作中,能使水的电离平衡向右移动,而且所得溶液显酸性的是
A.在水中加入少量氯化钠,并加热到100℃ B.在水中滴入稀硫酸
C.在水中加入小苏打 D.在水中加入氯化铝固体
12.向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入盐酸至过量,并将溶液加热,产生的气体与加入盐酸的物质的量的关系如图:


 则下列分析都正确的组合是:
则下列分析都正确的组合是:
|
|
溶液组成主要成分 |
对应图象 |
溶液中离子浓度关系 |
|
A |
NaHCO3、Na2CO3 |
Ⅱ |
c(CO32-) < c(HCO3-) |
|
B |
NaOH 、 Na2CO3 |
Ⅲ |
c(OH-)>c(CO32-) |
|
C |
Na2CO3 |
Ⅳ |
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
|
D |
NaHCO3 |
I |
c(Na+) = c(HCO3-) |
11.在25℃时,纯水的电离度为a1,pH=11的氨水中水的电离度为a2,pH=3的盐酸中水的电离度为a3。若将上述氨水与盐酸等体积混合,所得溶液中水的电离度为a4,则下列关系式正确的是
A.a1<a2<a3<a4 B.a3<a2<a1<a4
C.a2<a3<a1<a4 D.a2<a3<a4<a1
10.在10mL0.1mol·L-1NaOH溶液中加入同体积、同浓度的CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO-)+c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com