
10.草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10mL 0.01mol·L-1NaHC2O4溶液中滴加0.01mol·L-1NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是 ( )
A.V(NaOH) = 0时,c(H+)=1×102mol·L-1
B.V(NaOH) <10mL时, 不可能存在c(Na+)=2c(C2O42 -)+c(HC2O4- )
C.V(NaOH) = 10 mL时, c(H+) = 1×10-7mol·L-1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42 -)>c(HC2O4- )
9. 我国镍氢电池居世界先进水平,国产大功率镍氢动力电池已广泛用于我海军潜艇。常见镍氢电池的某极是储氢合金LaNi5,电池的总反应为:
LaNi5H6 +
6NiO(OH)  LaNi5 + 6Ni(OH)2(LaNi5H6中各元素化合价均为零),
LaNi5 + 6Ni(OH)2(LaNi5H6中各元素化合价均为零),
下列说法正确的是 ( )
A.放电时储氢合金作正极
B.充电时储氢合金作阴极
C.放电时,电流由负极通过外电路流向正极
D.充电时阴极反应:Ni(OH)2 + OH――e-= NiO(OH)+H2O
8.25℃时,在含有大量Ba2+的某澄清透明溶液中,由水电离产生的OH-物质的量浓度为
1×10-12mol/L,则在此溶液中还可能大量共存的离子组有 ( )
A.Na+、Fe2+、NO-3 B.K+、CH3COO-、SO2-4
C.NH+4、HCO-3、SCN- D.Cu2+、Mg2+、Cl-
7.下列说法不正确的是 ( )
A.根据沸点差异可以判断两种液体混合物是否可用蒸馏方法进行分离
B.根据固体溶解度曲线可以判断物质结晶的方法
C.根据熵变可以判断所有化学反应能否自发进行
D.根据化学平衡常数可以判断化学反应进行的限度
6.11.9g金属锡跟100mL 12mol·L-1 HNO3共热一段时间。完全反应后测定溶液中c(H+)为8mol·L-1,溶液体积仍为100mL。放出的气体在标准状况下体积约为8.96L。由此推断氯化产物可能是 ( )
A.SnO2·4H2O B.Sn(NO3)4
C.Sn(NO3)2 D.Sn(NO3)2和Sn(NO3)4
5.下列反应的离子方程式正确的是 ( )
|
A.以石墨作电极电解MgCl2溶液:2Cl-+2H2O ===== H2↑+Cl2↑+2OH-
B.在强碱溶液中次氯酸钠与Fe(OH)3生成Na2FeO4:
3ClO-+2Fe(OH)3=2FeO2-4+3Cl-+H2O+4H+
C.溴化亚铁溶液中加入过量氯水:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
D.向稀氨水中加入稀盐酸:NH3·H2O+H+=NH+4+H2O
4.设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.20g重水(D2O)中含有的电子数为10NA
B.足量Na2O2和0.5molCO2反应,转移电子数目为NA
C.标准状况下,aL CH4和aL乙醇中所含的分子数均为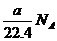
D.同温同压时,含原子个数相数的氢气和氦气所占的体积相等
3.下列说法中正确的是 ( )
A.在相同条件下,将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(s,石墨)=C(s,金刚石)△H=+1.9kJ·mol-1”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=+285.8kJ·mol-1,
2.生活中常用一些化学知识,下列分析中正确的是 ( )
A.医疗上可用硫酸钡作x射线透视肠胃的内服药,就是因为硫酸钡不溶于水
B.氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性
C. 某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中溶解的CO2增多
D.加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水
1.用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.③④ C.①③ D.②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com