
1.[2008肇庆一模]水是生命之源,也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为___ _______;
(2)H2O分子中氧原子采取的是 杂化。
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.水分子仍保留它的化学性质 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
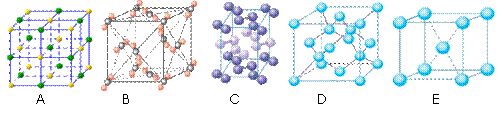
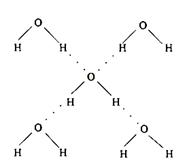 (5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
(7)分析下表数据,请写出你出的最具概括性的结论:
① ;
② 。
|
键型 |
键能 (kJ/mol) |
键长 (pm) |
分子 |
键角 |
物质 |
熔点(℃) |
沸点(℃) |
|
H-C |
413 |
109 |
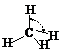 |
109.5º |
甲烷 |
-183.7 |
-128.0 |
|
H-N |
393 |
101 |
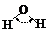 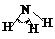 |
107 º |
氨 |
-77.7 |
-33.3 |
|
H-O |
463 |
96 |
|
104.5 º |
水 |
0.0 |
100.0 |
(1)1S22S22P6 (1分) (2)(1分)sp3 (3)(1分)A
(4)(2分)BC (5)(1分)20 (6)(1分)Cu2++4H2O=[Cu(H2O)4]2+
|
②上述氢化物氢原子间相离越远、分子越对称,分子间作用越弱(1分)
2[2008南海一模] 下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
|
|
|
|
|
|
④ |
|
|
|
|
|
|
|
|
|
|
⑤ |
|
|
⑥ |
⑦ |
|
|
|
⑧ |
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的常见化合物的晶体类型是________________。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构形为
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
(5) 1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。


在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________。
(1)⑨ (1分) (2)苯 (1分) 分子晶体 (1分)(3) 1 (1分)三角锥形 (1分)(4) Be(OH)2+2NaOH=Na2BeO2+2H2O (1分)(5)8 (1分)12 (1分)
3[2008惠州二模] 已知:
|


|




 R-CH2-C-CH2-R’
R-CH2-C-CH2-R’
|
|
|
|
 O
O
已知:A的结构简式为:CH3-CH(OH)-CH2-COOH ,现将A进行如下反应,B不能发生银镜反应, D是食醋的主要成分, F中含有甲基,并且可以使溴水褪色。
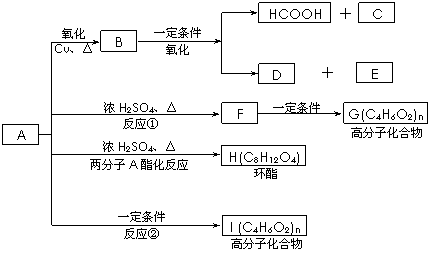
(1)写出C、E的结构简式:C_________ _、E_______ ;
(2)反应①和②的反应类型:①____________反应、②____________ 反应;
(3)写出下列化学方程式:
② F→G:_________________________________________________ ;
③ A→H:_________________________________________________ ;
(1)C:HOOC-CH2-COOH (2分)、 E:HOOC-COOH(2分)、
(2)消去,缩聚(各1分,共2分,答聚合也给分)
(3)
 ②
②
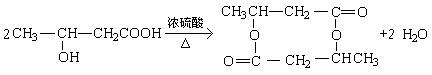
③
|
 (ⅰ)CH3CHCH3 --------→CH3CH==CH2 + (CH3)2CHOC2H5+HBr
(ⅰ)CH3CHCH3 --------→CH3CH==CH2 + (CH3)2CHOC2H5+HBr
|
 (ⅱ)CH3CH2CHCH3------→CH3CH==CHCH3+
CH3CH2CH==CH2+HX
(ⅱ)CH3CH2CHCH3------→CH3CH==CHCH3+
CH3CH2CH==CH2+HX

X为Cl 65% 35%
X为Br 75% 25%
X为I 80% 20%
(1)根据上面两个反应的条件及其数据,请写出你认为最具概括性的两条结论:① 。
②
。
(2)由丙烯经下列反应可制得化工原料H及F、G两种高分子化合物(它们都是常用的塑料),其合成线路如下:
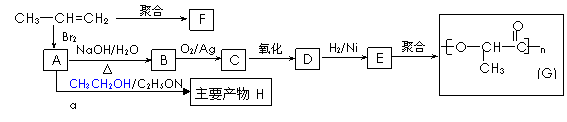
请完成下列填空:
①写出结构简式:聚合物F是 ,产物H ;
②B转化为C的化学方程式为: ;
③在一定条件下,两分子E能脱去两分子水形成一种元环状化合物,该化合物的结构简式是 。
4(1)[根据答到的要点或关键词给分]
①在此条件下,卤代烃的消去反应和取代反应同时进行(1分),有利于消去反应(1分)。
②在此条件下,有利于生成对称稀烃(1分),且卤原子半径越大(1分)越有利于生成对称稀烃(1分)。
若回答只是数据翻译,如:消去(取代)产物比例较大(小),或消去反应谁的比例大、谁的比例小,说出一点给1分,说出几点都如此最多给2分。

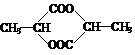
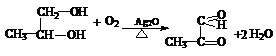 (2)①
(1分) CH3C≡CH (1分)
(2)①
(1分) CH3C≡CH (1分)
② (2分) ③ (1分)
第六讲
7.了解简单配合物的成键情况(配合物的空间构型和中心原子的杂化类型不作要求).
|
概念 |
表示 |
条件 |
|
共用电子对由一个原子单方向提供给另一原子共用所形成的共价键。 |
 A
B A
B电子对给予体 电子对接受体 |
其中一个原子必须提供孤对电子,另一原子必须能接受孤对电子的轨道。 |
(1).配位键:一个原子提供一对电子与另一个接受电子的原子形成的共价键.即成键的两个原子一方提供孤对电子,一方提供空轨道而形成的共价键.
(2).①.配合物:由提供孤电子对的配位体与接受孤电子对的中心原子(或离子)以配位键形成的化合物称配合物,又称络合物.
②.形成条件:a.中心原子(或离子)必须存在空轨道. b.配位体具有提供孤电子对的原子.
③.配合物的组成.
④.配合物的性质:配合物具有一定的稳定性.配合物中配位键越强,配合物越稳定.当作为中心原子的金属离子相同时,配合物的稳定性与配体的性质有关.
例30.下列不属于配合物的是
A.[Cu(NH3)4]SO4·H2O B.[Ag(NH3)2]OH
C.KAl(SO4)2·12H2O D.Na[Al(OH) 4]
例31.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
C.向反应后的溶液加入乙醇,溶液没有发生变化
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
例H3)5BrSO4可形成两种钴的配合物.已知两种配合物的分子式分别为[Co(NH3)5Br] SO4 和[Co (SO4) (NH3)5] Br, 若在第一种配合物的溶液中加入BaCl2 溶液时,现象是 ;若在第二种配合物的溶液中加入BaCl2溶液时,现象是 ,若加入 AgNO3溶液时,现象是 .
例32.产生白色沉淀 无明显现象 产生淡黄色沉淀
『综合模拟训练』
6.理解金属键的含义,能用金属键的自由电子理论解释金属的一些物理性质.知道金属晶体的基本堆积方式,了解常见金属晶体的晶胞结构(晶体内部空隙的识别、与晶胞的边长等晶体结构参数相关的计算不作要求).
(1).金属键:金属离子和自由电子之间强烈的相互作用.
请运用自由电子理论解释金属晶体的导电性、导热性和延展性.
|
晶体中的微粒 |
导电性 |
导热性 |
延展性 |
|
金属离子和自由电子 |
自由电子在外加电场的作用下发生定向移动 |
自由电子与金属离子碰撞传递热量 |
晶体中各原子层相对滑动仍保持相互作用 |
(2).①.金属晶体:通过金属键作用形成的晶体.
②.金属键的强弱和金属晶体熔沸点的变化规律:阳离子所带电荷越多、半径越小,金属键越强,熔沸点越高.如熔点:Na<Mg<Al,Li>Na>K>Rb>Cs.金属键的强弱可以用金属的原子化热来衡量.
例28.物质结构理论推出:金属晶体中金属离子与自由电子之间的强烈相互作用,叫金属键.金属键越强,其金属的硬度越大,熔沸点越高,且据研究表明,一般说来金属原子半径越小,价电子数越多,则金属键越强.由此判断下列说法错误的是
A.镁的硬度大于铝 B.镁的熔沸点低于钙 C.镁的硬度大于钾 D.钙的熔沸点高于钾
例29.金属的下列性质中和金属晶体无关的是
A.良好的导电性 B.反应中易失电子
C.良好的延展性 D.良好的导热性
5.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系.
(1).原子晶体:所有原子间通过共价键结合成的晶体或相邻原子间以共价键相结合而形成空间立体网状结构的晶体.
(2).典型的原子晶体有金刚石(C)、晶体硅(Si)、二氧化硅(SiO2).
金刚石是正四面体的空间网状结构,最小的碳环中有6个碳原子,每个碳原子与周围四个碳原子形成四个共价键;晶体硅的结构与金刚石相似;二氧化硅晶体是空间网状结构,最小的环中有6个硅原子和6个氧原子,每个硅原子与4个氧原子成键,每个氧原子与2个硅原子成键.
(3).共价键强弱和原子晶体熔沸点大小的判断:原子半径越小,形成共价键的键长越短,共价键的键能越大,其晶体熔沸点越高.如熔点:金刚石>碳化硅>晶体硅.
例26.下列说法正确的是(NA为阿伏加德罗常数)
A.电解CuCl2溶液,阴极析出16g铜时,电极上转移的电子数为NA
B.12 g石墨中含有C-C键的个数为1.5NA C.12 g金刚石中含有C-C键的个数为4NA
D.SiO2晶体中每摩尔硅原子可与氧原子形成2NA个共价键
例27.单质硼有无定形和晶体两种,参考下表数据
|
|
金刚石 |
晶体硅 |
晶体硼 |
|
熔点 |
>3823 |
1683 |
2573 |
|
沸点 |
5100 |
2628 |
2823 |
|
硬度 |
10 |
7.0 |
9.5 |
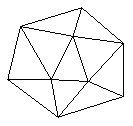 ①.晶体硼的晶体类型属于____________晶体,理由是________________________.
①.晶体硼的晶体类型属于____________晶体,理由是________________________.
②.已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子.通过观察图形及推算,此晶体体结构单元由____个B原子组成,键角_________.
例27.①.原子,理由:晶体的熔、沸点和硬度都介于晶体Si和金刚石之间,而金刚石和晶体Si均为原予晶体,B与C相邻与Si处于对角线处,亦为原于晶体.
②.每个三角形的顶点被5个三角形所共有,所以,此顶点完全属于一个三角形的只占到1/5,每个三角形中有3个这样的点,且晶体B中有20个这样的角形,因此,晶体B中这样的顶点(B原子)有3/5×20=12个.又因晶体B中的三角形面为正三角形,所以键角为60°
4.分子的空间立体结构(记住)
常见分子的类型与形状比较
|
分子类型 |
分子形状 |
键角 |
键的极性 |
分子极性 |
代表物 |
|
A |
球形 |
|
|
非极性 |
He、Ne |
|
A2 |
直线形 |
|
非极性 |
非极性 |
H2、O2 |
|
AB |
直线形 |
|
极性 |
极性 |
HCl、NO |
|
ABA |
直线形 |
180° |
极性 |
非极性 |
CO2、CS2 |
|
ABA |
V形 |
≠180° |
极性 |
极性 |
H2O、SO2 |
|
A4 |
正四面体形 |
60° |
非极性 |
非极性 |
P4 |
|
AB3 |
平面三角形 |
120° |
极性 |
非极性 |
BF3、SO3 |
|
AB3 |
三角锥形 |
≠120° |
极性 |
极性 |
NH3、NCl3 |
|
AB4 |
正四面体形 |
109°28′ |
极性 |
非极性 |
CH4、CCl4 |
|
AB3C |
四面体形 |
≠109°28′ |
极性 |
极性 |
CH3Cl、CHCl3 |
|
AB2C2 |
四面体形 |
≠109°28′ |
极性 |
极性 |
CH2Cl2 |
 |
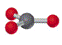 |
 |
 |
 |
 |
|
直 线 |
三角形 |
V形 |
四面体 |
三角锥 |
V形 H2O |
3.了解极性键和非极性键,了解极性分子和非极性分子及其性质的差异.
(1).共价键:原子间通过共用电子对形成的化学键.
(2).键的极性:
极性键:不同种原子之间形成的共价键,成键原子吸引电子的能力不同,共用电子对发生偏移.
非极性键:同种原子之间形成的共价键,成键原子吸引电子的能力相同,共用电子对不发生偏移.
(3).分子的极性:
①.极性分子:正电荷中心和负电荷中心不相重合的分子.
非极性分子:正电荷中心和负电荷中心相重合的分子.
②.分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定.
非极性分子和极性分子的比较
|
|
非极性分子 |
极性分子 |
|
形成原因 |
整个分子的电荷分布均匀,对称 |
整个分子的电荷分布不均匀、不对称 |
|
存在的共价键 |
非极性键或极性键 |
极性键 |
|
分子内原子排列 |
对称 |
不对称 |
举例说明:
|
分子 |
共价键的极性 |
分子中正负 电荷中心 |
结论 |
举例 |
|
同核双原子分子 |
非极性键 |
重合 |
非极性分子 |
H2、N2、O2 |
|
异核双原子分子 |
极性键 |
不重合 |
极性分子 |
CO、HF、HCl |
|
异核多原子分子 |
分子中各键的向量和为零 |
重合 |
非极性分子 |
CO2、BF3、CH4 |
|
分子中各键的向量和不为零 |
不重合 |
极性分子 |
H2O、NH3、CH3Cl |
③.相似相溶原理:极性分子易溶于极性分子溶剂中(如HCl易溶于水中),非极性分子易溶于非极性分子溶剂中(如CO2易溶于CS2中).
例20.根据科学人员探测:在海洋深处的沉积物中含有可燃冰,主要成分是甲烷水合物.其组成的两种分子的下列说法正确的是
A.它们都是极性键形成的极性分子 B.它们都只有σ键
C.它们成键电子的原子轨道都是sp3-s D.它们的立体结构都相同
2.了解共价键的主要类型σ键和π键,能用键能、键长、键角等数据说明简单分子的某些性质(对σ键和π键之间相对强弱的比较不作要求).
(1).共价键的分类和判断:σ键(“头碰头”重叠)和π键(“肩碰肩”重叠)、极性键和非极性键,还有一类特殊的共价键-配位键.
(2).共价键三参数.
|
|
概念 |
对分子的影响 |
|
键能 |
拆开1mol共价键所吸收的能量(单位:kJ/mol) |
键能越大,键越牢固,分子越稳定 |
|
键长 |
成键的两个原子核间的平均距离(单位:10-10米) |
键越短,键能越大,键越牢固,分子越稳定 |
|
键角 |
分子中相邻键之间的夹角(单位:度) |
键角决定了分子的空间构型 |
共价键的键能与化学反应热的关系:反应热= 所有反应物键能总和-所有生成物键能总和.
例18.下列分子既不存在s-p σ键,也不存在p-p π键的是
A.HCl B.HF C.SO2 D.SCl2
例19.下列关于丙烯(CH3-CH =CH2)的说法正确的
A.丙烯分子有8个σ键,1个π键 B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键 D.丙烯分子中3个碳原子在同一直线上
内容:离子键――离子晶体
1.理解离子键的含义,能说明离子键的形成.了解NaCl型和CsCl型离子晶体的结构特征,能用晶格能解释离子化合物的物理性质.
(1).化学键:相邻原子之间强烈的相互作用.化学键包括离子键、共价键和金属键.
(2).离子键:阴、阳离子通过静电作用形成的化学键.
离子键强弱的判断:离子半径越小,离子所带电荷越多,离子键越强,离子晶体的熔沸点越高.
离子键的强弱可以用晶格能的大小来衡量,晶格能是指拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能量.晶格能越大,离子晶体的熔点越高、硬度越大.
离子晶体:通过离子键作用形成的晶体.
典型的离子晶体结构:NaCl型和CsCl型.氯化钠晶体中,每个钠离子周围有6个氯离子,每个氯离子周围有6个钠离子,每个氯化钠晶胞中含有4个钠离子和4个氯离子;氯化铯晶体中,每个铯离子周围有8个氯离子,每个氯离子周围有8个铯离子,每个氯化铯晶胞中含有1个铯离子和1个氯离子.
|
NaCl型晶体 |
CsCl型晶体 |
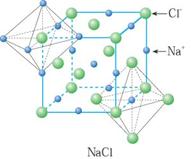 每个Na+离子周围被6个C1-离子所包围,同样每个C1-也被6个Na+所包围。 |
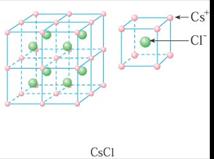 每个正离子被8个负离子包围着,同时每个负离子也被8个正离子所包围。 |
(3).晶胞中粒子数的计算方法--均摊法.
|
位置 |
顶点 |
棱边 |
面心 |
体心 |
|
贡献 |
1/8 |
1/4 |
1/2 |
1 |
例14.下列离子晶体中,熔点最低的是
A.NaCl B.KCl C.CaO D.MgO
例15.X、Y都是IIA(Be除外)的元素,已知它们的碳酸盐的热分解温度:T(XCO3)>T(YCO3),则下列判断正确的是
A.晶格能: XCO3>YCO3 B.阳离子半径: X2+>Y2+
C.金属性: X>Y D.氧化物的熔点: XO>YO
例16.萤石(CaF2)晶体属于立方晶系,萤石中每个Ca2+被8个F-所包围,则每个F-周围最近距离的Ca2+数目为
A.2 B.4 C.6 D.8
例17.01年曾报道,硼元素和镁元素形成的化合物刷新了金属化合物超导温度的最高记录.该化合物的晶体结构如图所示:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子;6个硼原子位于棱柱内,则该化合物的化学式可表示为
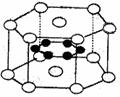 A.MgB B.MgB2 C.Mg2B D.Mg3B2
A.MgB B.MgB2 C.Mg2B D.Mg3B2
○镁原子,位于顶点和上下两个面心
●硼原子,位于六棱柱的内部
内容:共价键-分子晶体――原子晶体
4.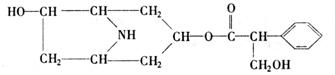 [2008珠海一模]某有机化合物A的结构简式如下:
[2008珠海一模]某有机化合物A的结构简式如下:
(1)A分子式是 。
(2)A在NaOH水溶液中加热反应得到B和C,C是芳香化合物。B和C的结构简式是
B: C:
该反应属于 反应。
(3)室温下,C用稀盐酸酸化得到E,E的结构简式是
(4)在下列物质中,不能与E发生化学反应的是(填写序号) 。
① 浓H2SO4和浓HNO3的混合液 ②CH3CH2OH(酸催化) ③CH3CH2CH2CH3 ④Na
⑤ CH3COOH(酸催化)
(5)写出同时符合下列两项要求的E的同分异构体的结构简式(写出其中的两种)。
①化合物是1,3,5-三取代苯
②苯环上的三个取代基分别为甲基、羟基和含有?C=O?结构的基团。
(1)C16H2l04N
第五讲
3.[2008珠海一模]“C1化学”是指以分子中只含一个碳原子的物质为原料进行物质合成的化学。下图是以天然气的主要成分为原料的合成路线流程图,其中“混合气体”的成分与水煤气相同;B的水溶液有杀菌防腐性能;D是C的钠盐,2mol D分子间脱去1mol H2分子可缩合生成E;H是F与A按物质的量之比为1∶2反应的产物。
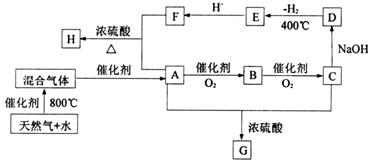
填写下列空白:
(1)天然气主要成分的电子式是 ;E的化学式是 。
(2)D、G的结构简式是D G 。
(3)写出下列反应式的化学方程:
A→B
A+F→H 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com