
18.I 实验室中打开盛有浓盐酸的试剂瓶,瓶口立即产生大量的白雾;把盛有浓氨水的试剂瓶打开,在瓶口却看不到白雾。对此,甲、乙、丙三位同学分别提出如下假设:
甲:NH3与水蒸气的结台能力不如HCl强,瓶口附近形成的氨水小液滴少,达不到肉眼可见的程度。
乙:浓氨水的挥发性不如浓盐酸强.瓶口附近空气中的NH3少.形成的氨水小液滴少.
产生的白雾达不到能被肉眼观察的程度。
丙:NH3的相对分子质量比HCl小,NH3的扩散速率比HCl快,由于挥发出的NH3快速地向四周扩散,形成的氨水小液滴不易集中.所以看不到白雾。
为了验证假设的上的正确性,三位同学在老师的指导下进行了下列实验:
如下图所示-取-根长50cm直径约2cm的玻璃管,水平放置在其两端分别同时塞入蘸有浓盐酸与浓氨水的棉球,立即用橡皮塞塞紧两端。数分钟后,玻璃管中在距离浓盐酸一端约18cm处开始产生白烟。
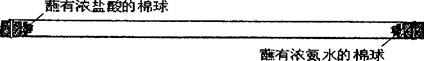
(1)在进行上述实验之前,甲同学就发现自己假设中的错误,确定甲假设中错误的理由是: 。
(2)上述实验中白烟产生在离浓盐酸一端约18cm处的事实.说明 。所以,关于浓氨水试剂瓶口看不到白雾的原因 的假设是正确的。
Ⅱ 氯化铵除了用作为肥料以外,也用在金属的焊接上,以除去金属表面的氧化物薄层。最近,我国又有学者将氯化铵用于制备无水氯化镁,其流程为:
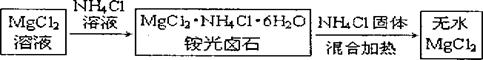
氯化铵的这两项用途也与上述实验中所观察到的现象密切相关。试同答下列问题:
(3)氯化铵的电子式为: 。
(4)在加热条什卜氯化铵能除去金属表面氧化物的原因:
(5)在制备无水氯化镁的过程中如果不添加一定量的氯化铵可能造成的结果:
16.BaCl2溶液中通入SO2气体无沉淀产生,若同时将另一种气体A通入BaCl2溶液中,产生白色沉淀,则A可能为 、 (要求填一种化合物和一种单质的化学式)。写出其中化合物A与上述溶液反应的化学反应方程式 。
 四、本题包括2小题,第17题共13分,第18题共10分。
四、本题包括2小题,第17题共13分,第18题共10分。
15.一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g)△H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g)△H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。

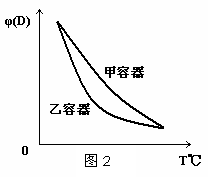
下列关于两容器中反应的说法正确的是 ( )
A.甲容器中的反应先达到化学平衡状态
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成不相同,混合气体平均相对分子质量也相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2 所示
D.在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度是乙中物质C的浓度的2倍
第Ⅱ卷(非选择题,共66分)
14.用石墨做电极电解AlCl3溶液时,下列电解液变化曲线合理的是 ( )

12.25℃时,下列各溶液中有关物质的量浓度关系正确的是 ( )
A.c(NH+4)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl)
B.Na2CO3溶液中:2c(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3)
C.NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:
c(Na+)>c(SO2-4)>c(NH+4)>c(OH-)=c(H+)
D.pH相同的CH3COONa溶液、C6H5ONa、溶液Na2CO3溶液、NaOH溶液:
c(CH3COONa)<c(Na2CO3)<c(C6H5Na)<c(NaOH)
 13.某容积一定的密闭容器中,可逆反应:
13.某容积一定的密闭容器中,可逆反应:
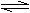 A(g)+B(g) xC(g)△H<0,符合下
A(g)+B(g) xC(g)△H<0,符合下
图所示图象(1)的关系。由此推断
对图象(2)的正确说法是( )
A.P3>P4,Y轴表示A的转化率
B.P3<P4,Y轴表示B的百分含量
C.P3>P4,Y轴表示混合气体密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
11.下列有关实验说法错误的是 ( )
A.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度
B.用10mL量筒量取5.80mL盐酸
C.做完银镜实验的试管应用稀硝酸洗涤
D.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
10.草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10mL 0.01mol·L-1NaHC2O4溶液中滴加0.01mol·L-1NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是 ( )
A.V(NaOH) = 0时,c(H+)=1×102mol·L-1
B.V(NaOH) <10mL时, 不可能存在c(Na+)=2c(C2O42 -)+c(HC2O4- )
C.V(NaOH) = 10 mL时, c(H+) = 1×10-7mol·L-1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42 -)>c(HC2O4- )
9. 我国镍氢电池居世界先进水平,国产大功率镍氢动力电池已广泛用于我海军潜艇。常见镍氢电池的某极是储氢合金LaNi5,电池的总反应为:
LaNi5H6 +
6NiO(OH)  LaNi5 + 6Ni(OH)2(LaNi5H6中各元素化合价均为零),
LaNi5 + 6Ni(OH)2(LaNi5H6中各元素化合价均为零),
下列说法正确的是 ( )
A.放电时储氢合金作正极
B.充电时储氢合金作阴极
C.放电时,电流由负极通过外电路流向正极
D.充电时阴极反应:Ni(OH)2 + OH――e-= NiO(OH)+H2O
8.25℃时,在含有大量Ba2+的某澄清透明溶液中,由水电离产生的OH-物质的量浓度为
1×10-12mol/L,则在此溶液中还可能大量共存的离子组有 ( )
A.Na+、Fe2+、NO-3 B.K+、CH3COO-、SO2-4
C.NH+4、HCO-3、SCN- D.Cu2+、Mg2+、Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com