
18.(8分)2010年8月7日甘肃舟曲发生特大泥石流灾害,专家指出,为防止大灾过后瘟疫发生,可用含氯消毒剂和过氧化物对环境消毒。
(1)气体二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在H2SO4存在下与Na2SO3溶液反应制得。请写出该反应的离子方程式:
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只作氧化剂的是 (填序号)。
A.MnO2
 B.KMnO4溶液
B.KMnO4溶液
C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温下于黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是 。
(4)物质的标准生成热是指由稳定的单质生成1mol指定物质时的热效应。如H2O(l)的生成热为-285.8 kJ·mol-1,用热化学方程式表示为 H2(s)+1/2O2(g)=H2O(l);△H=-285.8 kJ·mol-1。查表知ClO2的标准生成热是+102.5kJ·mol-1,则该反应用热化学方程式表示为_____________________________________________________。
17.(8分)有A、B、C三种可溶性正盐,其阴、阳离子各不相同,且阴离子的摩尔质量依次增大(按A、B、C的顺序),将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子,同时生成一种白沉淀。请回答下列问题:
(1)经检验,三种正盐中还含有下列离子中的一种,该离子是 (填字母)。
A.Na+ B.Mg2+ C.Cu2+ D.Ag+
(2)B的化学式为: 。
(3)等物质的量的A、B、C混合溶液的酸碱性用离子方程式表示为__________________。
(4)若将A、B、C三种正盐按一定比例溶于水后,所得溶液中只含有四种离子,且加入一定量的Ba(OH)2,溶液中只含有两种离子,设A为2mol,则C的物质的量为 。
16.将总物质的量为n mol的钠和铝(其中钠的物质的量分数为x),投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V L。下列关系式中正确的是
A.x=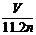 B.0<x≤0.5
B.0<x≤0.5
C.V=33.6n(1-x) D.11.2n<V≤22.4n
第Ⅱ卷 (非选择题;共60分)
15.将一定体积的CO2通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到a g沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到b g沉淀,则下列说法正确的是
A.参加反应的CO2体积为0.224a L
B.用上述数据不能确定NaOH溶液的物质的量浓度
C.若a=b,则CO2与NaOH溶液反应的盐只有Na2CO3
D.b可能等于a、小于a或大于a
14.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,33.6L氯气与足量的铝充分反应,转移电子数为3NA
B.标准状况下,22.4LHCHO分子中质子总数为16NA
C.室温下,28g乙烯和聚乙烯的混合物中含有的C=C键数为NA
D.1L浓度为1mol·L-1的Na2CO3溶液中阴离子所带电荷总数为2NA
13.工业上生产MnO2和Zn的主要反应有:
 ①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是
A.H2SO4氧化性大于MnO2 B.①中析出16 g S时转移l mol电子
C.②反应电解时阴极上Zn2+先放电 D.硫酸在该生产中可循环利用
12.有三种说法:①FeO与HNO3反应时硝酸只起酸的作用;②4FeS2+11O2→2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;③氧化还原反应中还原剂得电子数与氧化剂失电子数一定相等。这三种说法中错误的是
A.只有① B.只有②③ C.只有①③ D.①②③
11.已知热化学方程式:2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是
2SO3(g) ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是
A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量
B.将4 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ
C.若SO2(g)与O2(g)反应生成2 mol SO3(s),放热大于Q kJ
D.SO2(g)的燃烧热为Q/2 kJ·mol-1
10.下列离子方程式书写正确的是
A.明矾溶液中加入过量的氢氧化钡溶液:
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
B.用NaOH吸收少量SO2:SO2+OH-=HSO3-
C.小苏打与苛性钠溶液反应:H+ + OH- = H2O
D.硝酸亚铁溶液和稀盐酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑
9.密度为1.45g·cm-3的硫酸中,逐渐滴入BaCl2溶液直到沉淀完全为止,测得沉淀质量与原硫酸溶液质量相等,则原硫酸溶液物质的量浓度为
A.6.22 mol·L-1 B.12.22 mol·L-1 C.3.8 mol·L-1 D.16.8 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com