
16.(10分)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A: ;B: ;C: ;D: 。
(2)写出A、B、E三种微粒反应的离子方程式: 。
15.右图中横坐标为加入反应物的 物质的量,纵坐标为产生沉淀的物质的量。下列选项番号对应的曲线编号错误的是
物质的量,纵坐标为产生沉淀的物质的量。下列选项番号对应的曲线编号错误的是
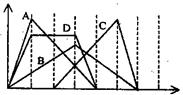 A.向NaAlO2溶液中滴入HCl至过量
A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中
通入CO2至沉淀消失
14.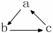 下列各组物质中,不能按
(“→”表示一步完成)关系相互转化的是
下列各组物质中,不能按
(“→”表示一步完成)关系相互转化的是
|
选项 |
A |
B |
C |
D |
|
a |
Fe |
SiO2 |
Al(OH)3 |
HNO3 |
|
b |
FeCl3 |
Na2SiO3 |
NaAlO2 |
NO |
|
c |
FeCl2 |
H2SiO3 |
Al2O3 |
NO2 |
13.根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H1= -Q1kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(1) △H2= -Q2kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g) △H3= -Q3kJ·mol-1
对△H1、△H2、△H3三者大小关系的判断正确的是
A.△H1>△H2>△H3 B.△H1>△H3>△H2
C.△H3>△H2>△H1 D.△H2>△H1>△H3
12.下列叙述合理的是
A.金属氧化物是碱性氧化物,酸性氧化物都不能与酸反应
B.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
|
 性,其消毒效率(单位体积气体得到电子的数目)是Cl2的5倍
性,其消毒效率(单位体积气体得到电子的数目)是Cl2的5倍
D.雷雨过后,感觉空气清新是因为在闪电时发生反应:N2+O2 2NO,使空气中含有一定量的NO
11.NA代表阿伏加德罗常数的数值,下列叙述错误的是
A.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,转移2NA个电子
B.23gNa在氧气中完全燃烧失去电子数为NA
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g[:]
D.常温常压下,33.6L Cl2与56g Fe充分反应,转移电子数为3NA
10.类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
|
|
已知 |
类推 |
||||
|
A |
将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ |
将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
||||
|
B |
稀硫酸与Ba(OH)2溶液反应至中性 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
NaHSO4溶液与Ba(OH)2溶液反应至中性 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
||||
|
C |
2Fe +3Cl2 ===== 2FeCl3 |
2Fe +3I2 ===== 2FeI3 |
||||
|
D |
向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
向Ca(ClO)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
9、下列各组溶液中的离子能大量共存,且向溶液中加入NaOH溶液时产生白色沉淀,加入盐酸时放出气体的一组是( )
A. OH-  Ba2+ NO3- K+
B.
Na+ SO42- Cu2+ Cl-
Ba2+ NO3- K+
B.
Na+ SO42- Cu2+ Cl-
C. HCO3- Cl- Na+ Ba2+ D. Fe2+ Fe3+ Br- NO3-
8.“鸟巢”被评为2008年世界最具影响力的十大建筑之一。合金钢Q460是支撑“鸟巢”的铁骨钢盘,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等元素。下列有关说法正确的是
A.铁位于元素周期表的第四周期第ⅧB族
B.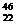 TiO2、
TiO2、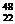 TiO2、、
TiO2、、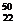 TiO2互为同位素
TiO2互为同位素
C.
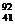 Nb3+原子核内有51个中子,核外有41个电子
Nb3+原子核内有51个中子,核外有41个电子
D.黑色金属材料通常包括铁、铬、锰以及它们的合金
7.下列 物质能通过化合反应直接制得的是:①FeCl2
②H2SO4 ③NH4NO3 ④HCl
物质能通过化合反应直接制得的是:①FeCl2
②H2SO4 ③NH4NO3 ④HCl
A.只有①②③ B.只有②③ C.只有①③④ D.全部
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com